自2019年疫情爆發以來,新冠病毒(SARS-CoV-2)造成的COVID-19大流行已經導致全球超過7.6億人次感染和694萬病例死亡,對公共衛生、社會和經濟基礎設施造成瞭嚴重的破壞。除瞭新冠病毒,季節性流感病毒每年導致近65萬病例死亡。且SARS-CoV-2和流感病毒具有相似的臨床表現、共同的傳播機制、相同的感染部位,且季節性吻合。據臨床報道顯示,感染流感病毒會增強SARS-CoV-2對宿主細胞的侵襲能力,從而導致新冠感染率升高、肺部損傷加重以及死亡率上升的情況。但目前已上市的新冠疫苗和流感疫苗分別隻針對新冠病毒和流感病毒提供保護,難以兼顧兩者。因此,開發一種能夠同時預防這兩種流行病的疫苗至關重要。
2023年6月23日,美國北卡羅來納州立大學程柯教授團隊在Science 子刊Science Advances發表瞭題為:A SARS-CoV-2 and influenza double hit vaccine based on RBD-conjugated influenza A virus的研究論文。該論文將SARS-CoV-2 刺突蛋白的受體結合結構域(RBD)與滅活的甲型流感病毒H1N1(Flu)相結合,研發瞭一個新型雙效疫苗,可同時針對流感病毒和新冠病毒。

新冠病毒是通過刺突蛋白的RBD與宿主細胞表面血管緊張素轉換酶2 (ACE2)受體相結合從而進入宿主細胞,這使得RBD成為中和抗體以及亞單位疫苗的特異性靶標。而自甲型H1N1流感病毒在人類中傳播以來,接種減活流感疫苗和滅活流感疫苗是預防流感大流行最行之有效的策略。其中,滅活流感疫苗表現出良好的安全性和內在免疫原性。受此啟發,程柯教授團隊通過click反應,將RBD結合到滅活甲型H1N1流感病毒表面(Flu-RBD),創造瞭針對新冠、流感、及新冠流感共感染的SARS-CoV-2病毒樣顆粒疫苗(VLP)。該疫苗具有雙重保護效果,不僅能誘導產生RBD特異性lgG抗體,還能激發血凝素(HA)抗原產生特異性抗體反應(圖1)。
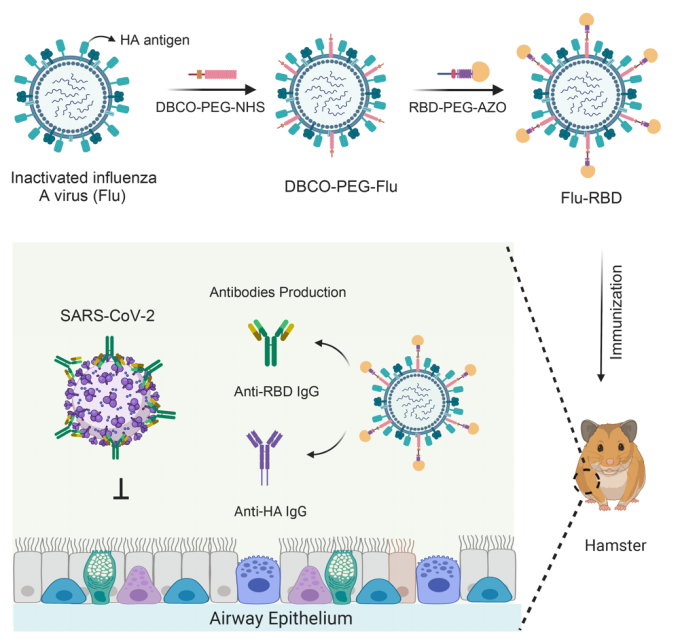
圖1:Flu-RBD VLP疫苗在倉鼠體內誘導產生RBD特異性抗體以及HA抗原特異性抗體。
成功制備Flu-RBD VLP疫苗後,該團隊研究瞭該疫苗誘導的免疫反應。研究結果顯示兩劑Flu-RBD VLP疫苗在小鼠體內誘導瞭強烈的體液免疫應答:相比於RBD與Flu簡單混合組(Flu-M-RBD),接種Flu-RBD的小鼠血清中檢測到瞭更高含量的RBD特異性IgG抗體(圖2B),同時Flu-RBD疫苗誘導瞭最為平衡的TH1免疫反應(圖2B和2C)。此外,該團隊發現Flu-RBD VLP疫苗可激活CD4+輔助性T細胞和CD8+細胞毒性T細胞,並誘導TH1偏向的免疫應答(圖2E和2F)。在驗證瞭Flu-RBD VLP疫苗具有新冠疫苗的應用潛力後,程柯團隊還證明瞭該疫苗保留瞭其作為流感疫苗的免疫原性:其誘導產生的HA抗體滴度(圖2G)與流感病毒疫苗相當,且主要是以lgG2a亞型為主(圖2H),同時可誘導產生IFN-γ+ CD4+ T細胞和IFN-γ+ CD8+ T細胞,表明其誘導的HA反應也是TH1偏向的免疫應答(圖2I和2J)。
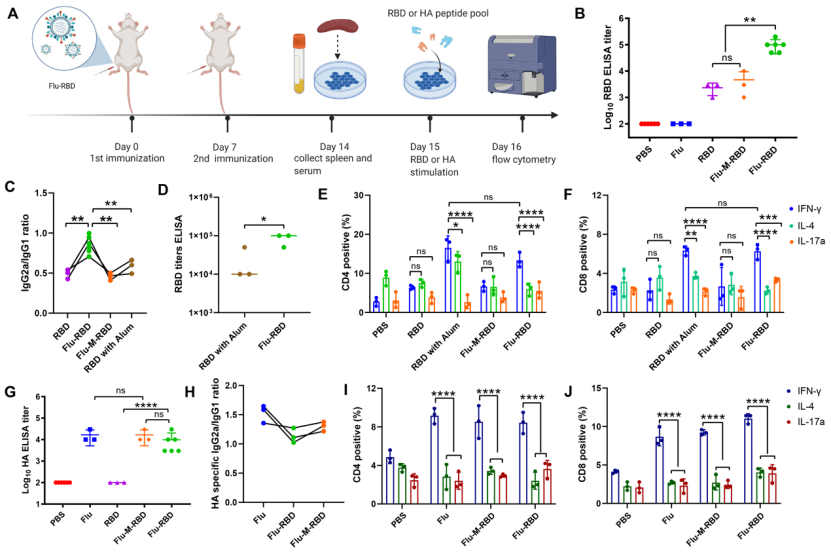
圖2:Flu-RBD VLP疫苗誘導小鼠產生體液免疫反應。(A)接種疫苗實驗設計。(B)小鼠血清中RBD抗體滴度。(C)RBD特異性的lgG2a與lgG1亞型抗體的比率。(D)比較Flu-RBD與RBD佐劑組誘導產生的抗體滴度含量。RBD肽段刺激後,脾細胞中CD4+ T細胞(E)和CD8+ T細胞(F)的IFN-γ+、IL-4+及IL-17+細胞百分比。小鼠血清中HA抗體滴度(G)和HA特異性lgG2a與lgG1亞型抗體的比率(H)。HA肽段刺激後,脾細胞中CD4+ T細胞(I)和CD8+ T細胞(J)的IFN-γ+、IL-4+及IL-17+的細胞百分比。
在成功驗證Flu-RBD VLP疫苗可誘導多重免疫反應後,該團隊應用COVID-19倉鼠模型評估Flu-RBD VLP疫苗預防新冠病毒的能力(圖3)。在接種兩劑Flu-RBD VLP疫苗後,成功降低瞭倉鼠的支氣管肺泡灌洗液(BAL)以及口腔拭子(OS)中的SARS-CoV-2病毒載量(圖3B和3C),並且能同時誘導產生RBD特異性的IgG抗體和HA特異性的IgG抗體(圖3D-F)。倉鼠肺組織病理學研究(H&E、Trichrome染色、組織病理學評分和Ashcroft評分)表明,相比於PBS、Flu和Flu-M-RBD組,接種Flu-RBD VLP的倉鼠肺炎癥狀明顯減輕,保留瞭肺泡組織上皮結構的完整性,同時降低瞭肺纖維化的發生(圖3G-J)。這些結果表明,Flu-RBD VLP疫苗能夠有效地保護倉鼠免受SARS-COV-2感染。
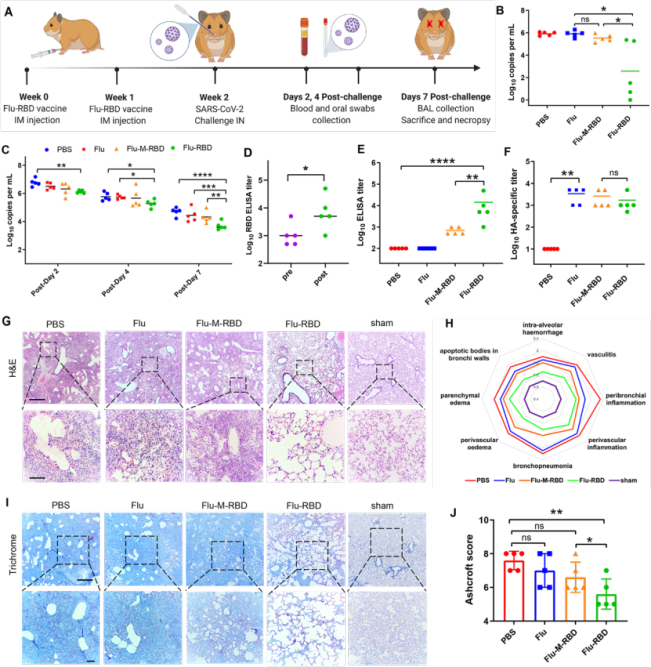
圖3:Flu-RBD VLP疫苗保護倉鼠免受SARS-CoV-2感染。(A)倉鼠實驗設計示意圖。(B)倉鼠BAL中的病毒載量。(C)倉鼠OS中的病毒載量。(D)倉鼠感染前和感染後RBD特異性lgG抗體滴度。感染後不同時間內,倉鼠血清中RBD (E)和HA (F)特異性的lgG抗體滴度。(G)倉鼠肺組織H&E染色。(H)倉鼠肺組織病理學雷達圖。(I)倉鼠肺組織Masson圖。(J)Ashcroft評分評估倉鼠肺纖維化。
SARS-CoV-2變異株的持續出現對新冠疫苗的預防效果構成瞭嚴重威脅,尤其是Delta變異株(B.617.2),導致許多國傢的新冠感染率急劇上升。然而,該團隊發現接種兩劑Flu-RBD VLP疫苗,可有效加快小鼠清除吸入的Delta變異株假病毒(圖4A-C)。激光共聚焦成像結果表示,相比於Flu,RBD和Flu-M-RBD組,接種Flu-RBD的小鼠肺支氣管及肺實質中的Delta假病毒信號表現出明顯的下降(圖4D-F)。此外,接種Flu-RBD小鼠的血清可有效阻止Delta假病毒進入表達ACE2的A549細胞內(圖4G和4H),表明其具有強大的交叉保護能力。
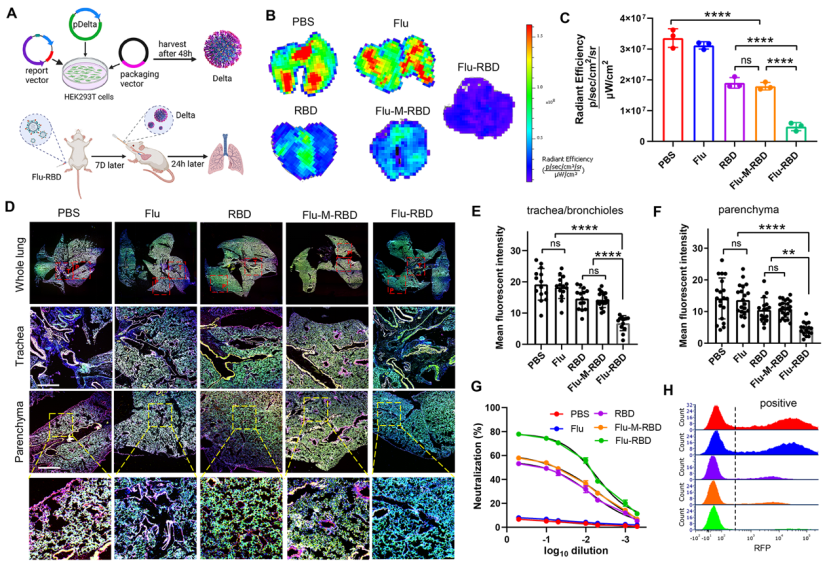
圖4:Flu-RBD VLP疫苗中和SARS-CoV-2 Delta假病毒。(A)制備SAR-CoV-2 Delta假病毒示意圖。小鼠肺組織Delta假病毒的ex-vivo成像圖(B)以及其定量分析(C)。(D)小鼠肺組織的激光共聚焦成像圖。小鼠肺支氣管、細小支氣管(E)及肺實質(F)的Delta假病毒定量分析。(G)接種疫苗後的小鼠血清中和Delta假病毒曲線圖。(H)接種疫苗後的小鼠血清抑制Delta假病毒進入宿主細胞的流式圖。
綜上所述,Flu-RBD VLP疫苗是針對SARS-COV-2、流感病毒及新冠、流感共感染的候選疫苗。不同於Novavax和Pfizer公司將新冠疫苗與流感疫苗進行簡單聯合接種,Flu-RBD VLP疫苗是一種能同時靶向兩種呼吸道病毒的單一疫苗,這種一箭雙雕的疫苗更具成本效益,增強瞭免疫原性,提高瞭患者的便利性,能緩解公眾對疫苗接種的疲勞。該疫苗將為開發針對循環病毒共感染的疫苗提供新的見解,值得進一步的研究與開發。
程柯教授是本文的通訊作者。王真真博士(現全職加入華南理工大學生物醫學科學與工程學院)為本文的第一作者。




發表評論 取消回复