本文作者:以酥
3200 万,足以在北京二环内买到一套四合院。对有的家庭来说,这个一辈子都挣不到的数字,却意味着一个救命的机会。
近期,Nature Medicine 上发表了一篇特别的研究报告——这是一项只纳入了 1 位患者的临床试验,而患者的父亲,正是论文的作者之一。

图源:参考资料 1
他在短短几年的时间里,为身患绝症的儿子募集超过 450 万美元(约合人民币 3200 万元)资金,从零创立了一家生物技术公司、参与儿子的治疗方案设计,逐步攻克了这个无人踏足的疾病领域。
在这篇研究背后,是一对父母将「不可能」改写为「可能」的传奇故事。
1 岁半确诊必死绝症,父母决心为他「逆天改命」
迈克尔出生于 2017 年 12 月 17 日,是家中最小的儿子。然而,还没等迈克尔一家庆祝他的到来,噩耗便接踵而至。

迈克尔一家
图源:参考资料 2
首先是迈克尔的母亲「感受到了不对劲」:迈克尔的发育里程碑明显要落后于正常水平,在他 5 月龄的时候,仍然无法抬头或举起双手。他们甚至发现,儿子在进行抓握时,手指好像总是没有力气。
强烈不安感的驱使下,这对夫妇带着迈克尔开启了求医之路。神经系统专科体检发现,迈克尔的肌张力降低,头颅磁共振提示薄胼胝体和脑白质异常信号。并且在随后不久,迈克尔就出现了一次癫痫大发作。
2019 年(此时迈克尔 18 月龄),基因检测显示,迈克尔的 AP4M1 基因存在复合杂合突变,变异导致该基因编码的衔接蛋白复合体 4 功能丧失。由此基因变异导致的疾病被称为遗传性痉挛性截瘫 50 型(SPG50),这类疾病的症状通常在婴儿期出现,包括全面发育迟缓、进行性小头畸形和颅脑磁共振异常 [1]。
SPG 50 是一种相当罕见的疾病,且该疾病是慢性进展的,患者会因为痉挛逐渐丧失运动能力从而致残、伴随严重的认知功能障碍,往往活不到成年阶段。目前,已知全世界范围内受到影响的患者也不过 80 人,迈克尔则是加拿大唯一确诊的 SPG 50 患者 [1]。
迈克尔的父母不愿就此放弃,他们想尽各种办法寻找救治机会:与患有类似罕见疾病(SGP47、SPG15、CMT4J 等)患者的家人交流、阅读医学文献、参加学术会议……在美国的一场基因与细胞治疗学会的会议上,他们把儿子的疾病信息印成「通缉令」式传单到处分发,寻找有可能了解 SPG50 的专家。

迈克尔父亲发布的「通缉令」 图源:参考资料 2
凭借着这种「土」办法,他们成功联系到美国一位著名的分子生物学家。这位专家告诉迈克尔的父母,通过基因编辑的方法可以修复迈克尔受损的基因。但不幸的是,针对 SPG50 的基因治疗尚未被发明,且根据其「一对一定制」的特点,研发至少需要 300 万美元。
没有犹豫,迈克尔的父母立刻变卖了所有家产。只不过,仅靠家庭积蓄还远远不够。他们成立了基金会,并开始联系可以提供帮助的机构与组织——来自美国的实验室提供了小鼠模型,波士顿儿童医院和美国国立卫生研究院等机构提供研究支持,加拿大多伦多病童医院的医生为迈克尔设计治疗方案。
很快,善款突破 450 万美元 [3],相关研究也进展飞速。
花费超 3200 万,打造只有 1 个人的临床试验
基因治疗,是指将包含正常基因的 DNA 序列通过载体导入细胞内,使之产生目的基因的产物,从而达到治疗该基因缺陷所致疾病的目的。
重组腺相关病毒载体 9 型(AAV9)已被证明是一种安全有效的载体,可通过鞘内给药将基因的功能性拷贝递送至中枢神经系统。这种给药途径也被广泛应用于治疗中枢神经系统疾病的临床前和临床研究。[4]
从理论上讲,SPG50 是基因治疗的「理想候选疾病」:AP4M1 基因编码序列很短(1,359 bp),非常适合自身互补型腺相关病毒(scAAV)载体。AAV9/AP4M1 构建体可大量表达 AP4M1 蛋白,从而帮助患者恢复正常的 AP4M1 蛋白功能。
在临床前研究阶段,鞘内 AAV9/ AP4M1 基因治疗显示出安全性和有效性,且早期干预和较高剂量可获得最佳治疗效果 [4],目标剂量被定为 10ml,1×10^15 个载体基因组。
2021 年 12 月 30 日,基于治疗团队提供的临床前研究,加拿大卫生部正式批准了该治疗方案的 I 期临床试验;2022 年 2 月,临床试验获得机构伦理委员会的批准。同年 3 月,这场只有 1 个人的临床试验正式展开。
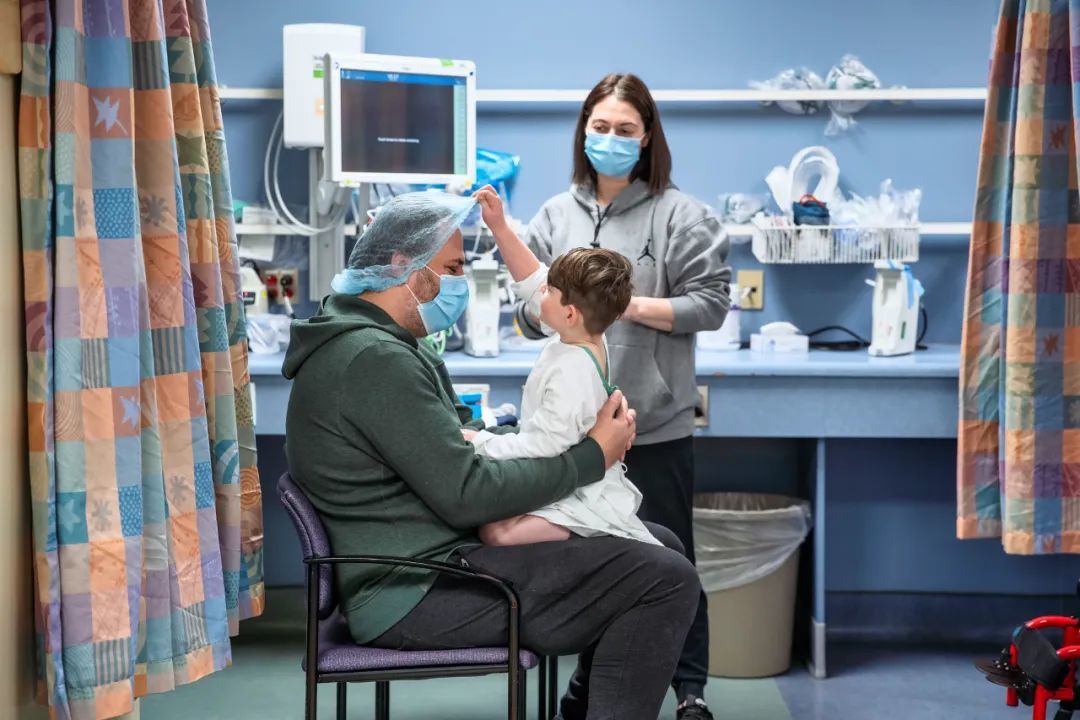
迈克尔与父母
图源:参考资料 5
研究人员通过腰椎穿刺鞘内注射给药的方式,将 AAV9-AP4M1 注射进迈克尔体内,同时还进行了 AP4M1 蛋白免疫抑制治疗。试验的主要结果是安全性和耐受性,次要终点评估疗效。
在接受治疗后的 12 个月内,迈克尔没有出现任何严重的副作用,也没有再发生跌倒或癫痫发作。在第 3、6 和 12 个月的头颅磁共振增强、脊柱 MRI 平扫提示未见炎症相关改变,脑萎缩无进展。
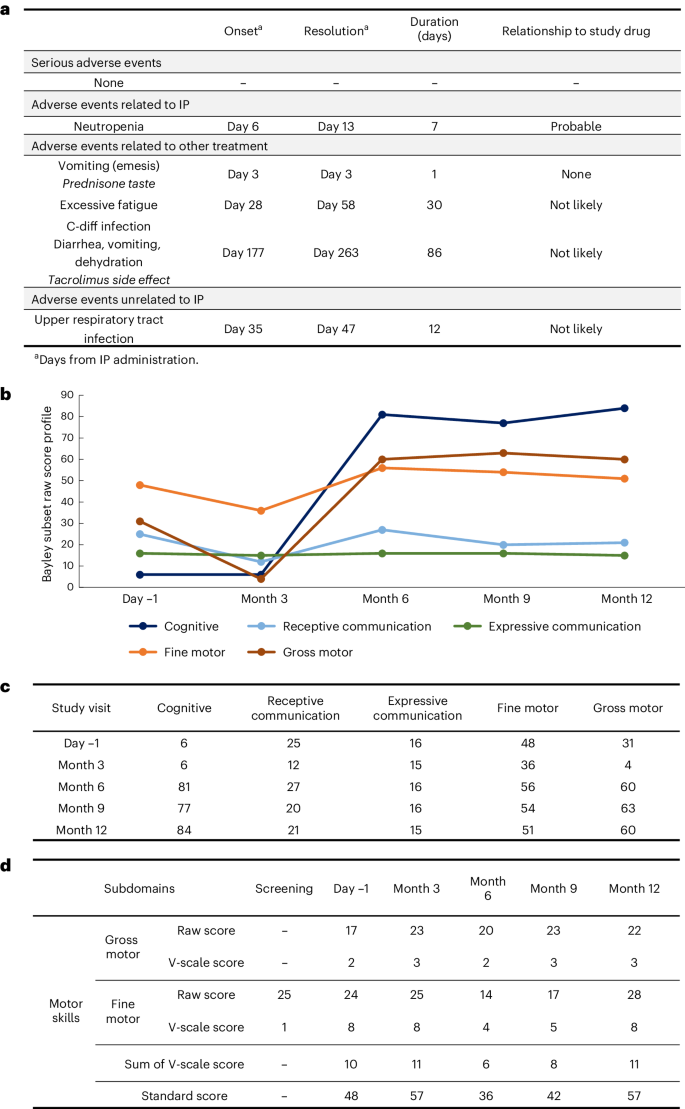
SPG50 单一患者治疗试验中的安全性和有效性(贝利婴儿发育量表)
图源:参考资料 1
甚至在治疗期终点,迈克尔已经不用依赖轮椅,可以自己用脚后跟站立。

图源:参考资料 6
这项鼓舞人心的临床试验结果已于 6 月 28 日发表在 Nature Medicine 上。临床研究团队指出,目前仍在持续关注迈克尔的病情进展,但此次试验为基因治疗在减缓或阻止 SPG50 进展方面的安全性和有效性提供了重要的初步证据。
III 期临床试验将于今年开展
在儿子生病前,迈克尔的父亲在电信和科技行业工作了 25 年,直至突如其来的变故改变了这一切 [7]。
「2019 年 4 月 2 日,迈克尔被确诊。一个月后,我在华盛顿与世界各地的专家会面。三天后,我们花光了毕生积蓄。一年半后,我们开始进行安全性研究。(确诊的)两年后,我们制造了这种药物,让迈克尔(确诊)不到三年内就接受了基因治疗。」[3]
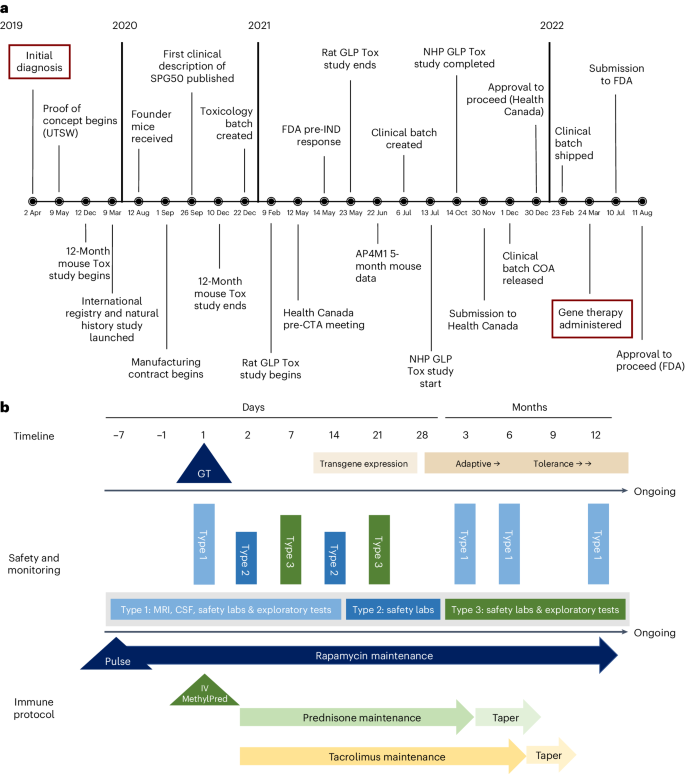
从患者诊断到患者用药,SPG50 基因疗法的开发时间表
图源:参考资料 1
从确诊 SPG50 到让儿子用上药物,迈克尔的父母只花费了两年半的时间,便完成了这项从「无」到「有」的突破。这也让他们看到,基因治疗的未来潜力,可以帮助更多像迈克尔一样的罕见病患者。
2023 年,迈克尔的父亲辞去工作,创办了一家非营利性生物技术公司,专门为那些无法吸引传统生物制药公司的罕见病患者群体开发基因疗法。
除了针对 SPG50 的基因治疗外,该公司还研发了一款针对 CMT4J(夏科-马里-图斯病 4J 型)的基因疗法,这种疾病全球仅有 24 例。目前,该药物还属于处于临床前阶段,预计很快启动 I 期临床试验。[8]
2023 年,生物技术行业媒体 Fierce Biotech 将年度「突破奖项」颁发给迈克尔的父亲——特里·皮罗沃拉基斯(Terry Pirovolakis)(同年同获此奖的还有 2023 年的诺奖获得者卡塔琳・卡里科)。

特里荣获 Fierce 50 Breakthrough 奖项
图源:参考资料 7
FDA 目前已批准针对 SPG50 基因疗法的 III 期临床试验,该药物被称为 Melpida [注 1],将于 2024 年 8 月开始,预计纳入 8 名患者。公司预计,进一步的临床试验可能需要 2100 万美元(约合人民币 1.5 亿元)。
「我已决定将毕生精力投入到拯救更多孩子上。」特里说道,「这些临床研究需要有人来买单,为此,我将放弃一切财富。」
注 1:特里创立的公司名为 Elpida,希腊语意为「希望」。Melpida=Michael+Elpida,意味「迈克尔的希望」。
致谢:本文经 山东大学齐鲁医院神经内科 温冰、浙江大学医学院附属第二医院医学遗传科/罕见病诊治中心 韦巧 专业审核
策划:ame|监制:carollero




發表評論 取消回复