這裡是《21健訊Daily》,歡迎與21世紀經濟報道新健康團隊共同關註醫藥健康行業最新事件!
一、政策動向
●國傢藥監局發佈《中藥飲片標簽管理規定》
7月14日,國傢藥監局公開發佈關於《中藥飲片標簽管理規定》的公告(2023年第90號)。
為進一步規范中藥飲片標簽的管理,根據《中華人民共和國藥品管理法》《中華人民共和國藥品管理法實施條例》《藥品說明書和標簽管理規定》等法律、行政法規和規章,國傢藥監局組織制定瞭《中藥飲片標簽管理規定》,現予發佈,自2024年8月1日起施行,其中,保質期的標註自2025年8月1日起施行。
●粵港澳大灣區首個跨境生產藥品正式投產上市
據廣東省藥監局7月14日消息,近期,香港聯邦制藥廠有限公司跨境委托其在粵港澳大灣區內地關聯公司珠海聯邦制藥股份有限公司中山分公司生產的維生素C泡騰片正式在內地投產上市並銷售,標志著國傢支持港澳藥品上市許可持有人在大灣區內地9市生產藥品的政策順利落地實施並取得實效。這對於開創性地推動粵港澳大灣區醫藥產業融合發展具有重要的示范作用。
以往港澳藥品參照境外藥品管理,大部分藥品生產場地在港澳本地,但由於港澳地區制造廠生產場地有限,產能容易出現不足。根據現行的法律法規要求,境外持有人在內地跨境生產藥品全國並無先例。
為推動粵港澳大灣區醫藥產業深度融合、協同發展,國傢藥監局等部門聯合發佈《粵港澳大灣區藥品醫療器械監管創新發展工作方案》,提出在粵港澳大灣區開展藥品上市許可持有人制度改革,支持港澳藥品上市許可持有人將持有的藥品在粵港澳大灣區內地9市符合條件的企業生產。
二、藥械審批
●恒潤達生首個實體瘤CAR-T細胞療法獲批臨床試驗
7月12日,細胞治療企業恒潤達生宣佈,其自主研發的抗人CD70 T細胞註射液(代號:HR010,適應癥:晚期/轉移性腎癌)正式獲國傢藥品監督管理局藥品審評中心(CDE)註冊臨床默示許可,這也是恒潤達生首個實體瘤CAR-T細胞治療藥物獲批IND。
至此,恒潤達生已獲5個1類創新型生物制品(CAR-T細胞治療產品)註冊臨床批件。
●渤健在華遞交“漸凍癥”療法“托夫生註射液”新藥上市申請
7月14日,中國國傢藥監局藥品審評中心(CDE)官網最新公示,渤健(Biogen)遞交瞭5.1類新藥托夫生註射液的上市申請,並獲得受理。公開資料顯示,這是渤健和Ionis Pharmaceuticals聯合開發的反義寡核苷酸(ASO)療法Qalsody(tofersen),也是FDA批準治療遺傳性肌萎縮側索硬化(ALS)的首款療法。
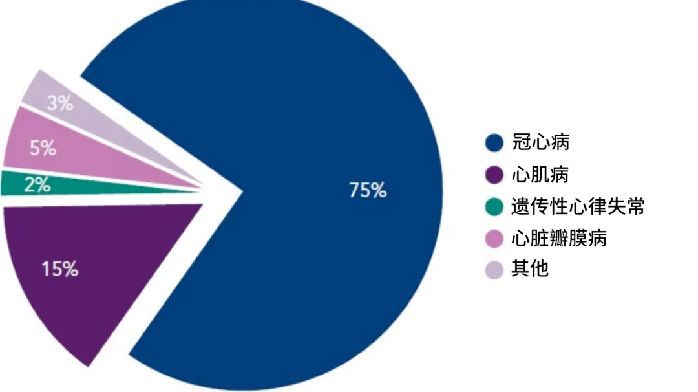
肌萎縮側索硬化癥(ALS)是一種進行性神經退行性疾病,影響大腦和脊髓中的神經細胞,也被稱為“漸凍癥”。這種疾病的患者大腦和脊柱的運動神經元會不斷死亡,導致患者的肌肉無力和癱瘓,從無法行走到無法說話、吞咽、呼吸。ALS患者在確診後平均壽命小於5年。目前,許多基因被認為與此疾病有關聯,其中具有超氧化物歧化酶1(SOD1)突變的患者(SOD1-ALS)約占瞭2%。這些患者中大部分疾病進展迅速,發病後甚至無法活過1年。
三、資本市場
●健適醫療擬赴港IPO
近日,市場消息稱,新興醫療科技公司健適醫療已聘請中信證券、高盛集團、摩根士丹利等為顧問,最快或於明年在港交所IPO。
公開資料顯示,健適醫療成立於2019年,由前波士頓科學中國CEO王欣創立,致力於打造開放的醫療科技平臺。健適醫療在中國(無錫、蘇州、天津、南通、上海)、美國(加利福尼亞州、明尼蘇達州)、日本(東京)和新加坡成立瞭研發中心,不斷完善以微創外科、血管介入(神經介入/心臟介入/外周介入)、結構性心臟病為特色的產品組合。
●和鉑醫藥發佈2023年度上半年正面盈利預告
7月13日,港股上市企業和鉑醫藥發佈公告,公司截至2023年6月30日止上半年的財務表現呈現顯著增長,預期總收入增加並實現扭虧為盈,降本增效成果顯著。
根據對公司截至2023年6月30日止六個月未經審計管理帳目的初步審閱,預期公司上半年總收入約為4000萬美元,同比增長約44.9%。期內盈利約200至400萬美元,而上年同期為虧損約7310萬美元。據此,公司預計將實現首次半年度盈利,主要得益於基於創新管線產品合作、創新技術合作推動的收入持續增長及通過運營優化所實現的降本增效。
四、行業大事
●世界衛生組織正式宣佈:阿斯巴甜可能致癌
7月14日,國際癌癥研究機構、世界衛生組織和糧食農業組織食品添加劑聯合專傢委員會發佈瞭無糖甜味劑阿斯巴甜對健康影響的評估報告。國際癌癥研究機構援引對人類致癌性的“有限證據”,將阿斯巴甜歸為可能對人類致癌之列(國際癌癥研究機構第2B組),聯合專傢委員會重申其每日允許攝入量為每公斤體重40毫克。
阿斯巴甜是一種人造(化學)甜味劑,自20世紀80年代以來廣泛用於各種食品和飲料制品,包括減肥飲料、口香糖、明膠、冰淇淋、酸奶等乳制品、早餐麥片、牙膏和止咳藥水和維生素咀嚼片等藥物。這是國際癌癥研究機構首次對阿斯巴甜進行評估,也是聯合專傢委員會對其開展的第三次評估。
●奧林巴斯醫療株式會社對電子上消化道內窺鏡等主動召回
7月14日,國傢藥監局發佈產品召回公告稱,奧林巴斯貿易(上海)有限公司報告,由於部分產品缺失最終檢驗工作標準,生產商奧林巴斯醫療株式會社對電子胃鏡(國食藥監械(進)字2012第3220572號、國食藥監械(進)字2013第3221990號)、電子大腸內窺鏡大腸ビデオスコープ(國械註進20172067070)、電子結腸鏡(國食藥監械(進)字2012第3220852號、國食藥監械(進)字2013第3224358號)、電子十二指腸鏡(國食藥監械(進)字2011第3222826號)、電子上消化道內窺鏡(國械註進20153063036、國械註進20183062529)、電子十二指腸鏡十二指腸ビデオスコープ(國械註進20163063273)主動召回。召回級別為三級召回。涉及產品的型號、規格及批次等詳細信息見《醫療器械召回事件報告表》。



發表評論 取消回复