隨著肺癌發病率的逐年上升和早篩方法的不斷成熟,全世界范圍內肺癌流行現狀也日漸轉變 —— 早期肺癌占比正在持續上升。基於此,早期肺癌的治療、評估和預後也逐漸成為腫瘤治療領域的重要議題。在 2023 年 6 月 16~18 日召開的中國肺癌學術大會上,來自中國醫學科學院腫瘤醫院的高樹庚教授從外科醫生的視角,分析瞭早期非小細胞肺癌(NSCLC)預後情況的預測因素。

-現狀:Ⅰ期患者占比上升,生存獲益仍有待提高-
高樹庚教授首先回顧瞭近年來國內外肺癌疾病譜的顯著特征 —— 早期肺癌占比持續上升,Ⅰ 期患者成為我國胸外科接診肺癌患者的主體:
美國國傢癌癥研究所監測,流行病學和最終結果數據庫(SEER):2010-2017 年,美國 NSCLC 總發病率降低,I 期占比呈逐年上升趨勢 (24%→29%),Ⅳ 期占比逐年下降;
美國國傢癌癥數據庫(NCDB):2010-2017 年美國 NSCLC Ⅰ 期發病率占比由 2010 年的 23.5% 上升至 2017 年的 29.1%;
中國醫學科學院腫瘤醫院內部數據:2015-2022 年肺癌手術Ⅰ期患者占比逐年上升,目前占所有可手術患者比例已接近 90%;
2022 年第十一屆廣州肺癌論壇報告中國真實世界數據:Ⅰ期患者約占可手術 NSCLC 的 59.1%。
雖然做到瞭早篩、早診、早治,但是早期 NSCLC 患者的生存獲益仍有待提高,高樹庚教授指出,ⅠA 期患者的 5 年生存率僅有 77%~92%,ⅠB 期患者的 5 年生存率更低,僅有 68%,表明有相當一部分早期 NSCLC 患者的長期生存獲益並不理想。為瞭改善這一現狀,高樹庚教授認為應該分析早期肺癌預後的不良因素,並且針對不良因素采取相應的治療措施。
-關註病理亞型:早期 NSCLC 療效的首要預測因素-
高樹庚教授指出,肺癌病理亞型分類經歷瞭從粗糙到精細,從關註鏡下形態學差異到關註臨床預後差異的變遷,原位腺癌的地位逐漸降低。高樹庚教授總結瞭不同病理亞型對早期 NSCLC 預後的影響:
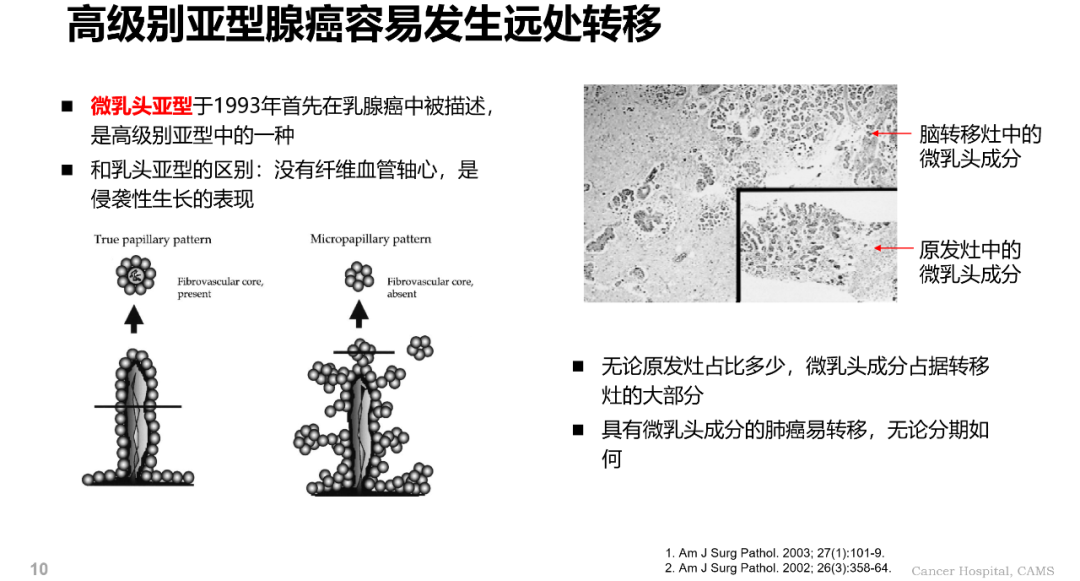
高級別亞型腺癌如微乳頭亞型腺癌容易發生遠處轉移,預後較差:微乳頭亞型腺癌沒有纖維血管核,是侵襲性生長的表現;無論分期如何、原發病灶占比多少,具有微乳頭成分的肺癌都容易發生轉移。微乳頭亞型還可進一步細分為經典花瓣型微乳頭結構(細胞團包含 1-20 個腫瘤細胞)和巢狀微乳頭結構(大於 20 個腫瘤細胞),後者預後更差。
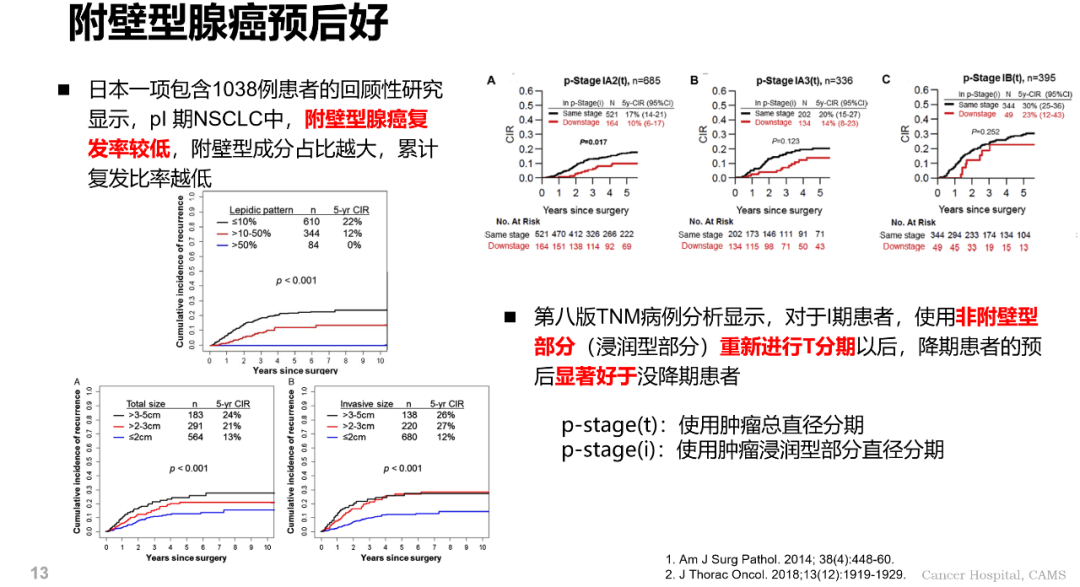
附壁型腺癌預後好:日本一項包含 1038 例患者的回顧性研究提示 pl 期 NSCLC 中,附壁型腺癌復發率較低,附壁型成分占比越大,累計復發比率越低。第八版 TNM 病例分析顯示,對於Ⅰ期患者,使用非附壁型部分(浸潤型部分)重新進行 T 分期以後,降期患者的預後顯著好於沒降期患者。影像學上的磨玻璃成分往往對應病理中的附壁型成分,日本一項回顧性研究顯示:純實性組預後顯著差於接近純實性組 (IA 期患者 5 年 OS 71.8% vs 92.8%),表明含有磨玻璃成分的結節預後良好。
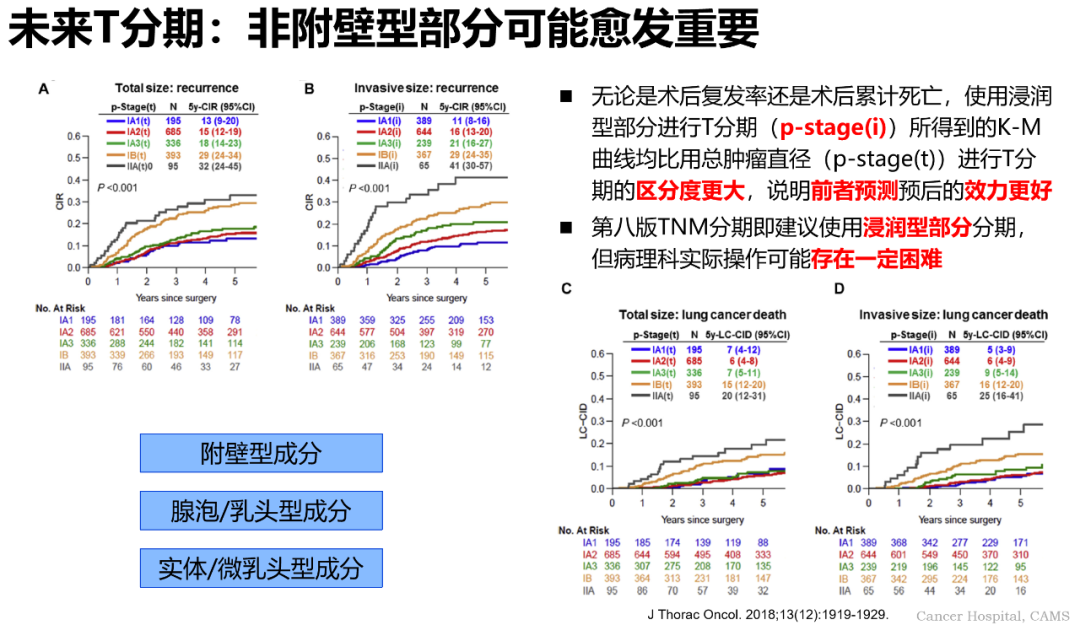
通過對上述兩種病理亞型的分析,高樹庚教授認為,在未來的肺癌 T 分期中,附壁型可能被剔除,因為無論是術後復發率還是術後累計死亡,使用浸潤型部分進行 T 分期 [p-stage(i)] 所得到的 K-M 曲線均比用總腫瘤直徑 [p-stage(t)] 進行 T 分期的區分度更大,說明前者預測預後的效力更好。
-手術方式重要嗎?對早期 NSCLC 預後影響如何?-
早期 NSCLC 治療主要以外科手術為主,不同的手術方法對預後的影響也需要考慮在內。高樹庚教授首先肯定瞭肺段手術的療效 —— 來自日本的 JCOG0802 研究顯示,肺段切除組患者的總生存(OS)顯著優於肺葉切除組。高樹庚教授指出,肺段手術的優勢在於呼吸功能保留優於肺葉切除組,但需要註意的是,肺段手術組對呼吸功能的保留僅僅是略好於肺葉切除組,這與傳統觀念有所差異。
此外,根據 CALGB140503 研究結果來看,對於外周型早期肺癌,亞肺葉切除術與肺葉切除術具有相似的遠期生存效果,5 年無病生存(DFS)率分別為 63.6% 和 64.1%;5 年 OS 率分別為 80.3% vs 78.9% 術後復發率無統計學差異。
早期肺癌手術應該如何優化,才能既簡單,又能取得良好的治療效果呢?高樹庚教授結合中國醫學科學院腫瘤醫院 3300 餘例解剖型部分肺葉切除術(APL)的臨床經驗指出,這一術式是安全、合理、有效的針對 NSCLC 的手術策略,APL 的手術要點包括:
依據肺組織氣、血雙重供應的解剖特點,以腫瘤學原則(切緣距離)為基礎,以保留更多健康肺組織為目的,基於肺段解剖結構的部分肺葉切除;
基於解剖流域特點,可以隻處理部分段門結構(動脈、靜脈、支氣管)的部分肺葉切除。
在會議上,高樹庚教授還分享瞭中國醫學科學院腫瘤醫院接受 APL 治療的早期 NSCLC 患者的與預後情況,包括患者生存數據、病理類型分析、復發進展分析和預後危險因素分析。
在 906 例 APL 患者中,5 年 OS 和 8 年 OS 分別達到 96.8% 和 95.4%,5 年無復發生存率(RFS)和 8 年 RFS 分別為 96.6% 和 94.3%。
接受 APL 治療的患者主要為原發性腺癌患者(n = 752),這部分患者接受 APL 術式最多的類型為多肺段/聯合段切除(47.7%),其次為 4 種簡單肺段切除(42.4%),單一肺段切除患者較少(9.9%)。
原發性腺癌患者 APL 術後 5 年 OS 和 8 年 OS 分別為 97.2% 和 95.8%;5 年 RFS 和 8 年 RFS 分別為 96.7% 和 94.1%。
752 例原發性腺癌患者中腫瘤進展患者 38 例(多發 12 例,單發腫瘤 26 例);死亡患者 27 例;腫瘤特異性死亡 17 例(單發 10 例,多發 7 例);其他原發腫瘤導致死亡 2 例;其他疾病死亡 8 例子(轉移部位)。
影響接受 APL 的原發肺腺癌患者預後的危險因素包括性別(女性預後更差)、吸煙史、手術方式(腔鏡預後較開胸手術更好)、多原發腫瘤預後較單發更差。
高樹庚教授總結稱:解剖性部分肺葉切除術對於早期肺癌安全、可行、推廣性好,患者預後較好,和國際多個前瞻性研究隊列可比。
淋巴清掃也與患者與預後密切相關。高樹庚教授指出,肺葉特異性淋巴結清掃對於 I 期肺癌效果良好,而早期 NSCLC 的淋巴清掃原則應該是在分期正確的前提下進行靈活的淋巴結清掃,而非盲目擴大清掃范圍。
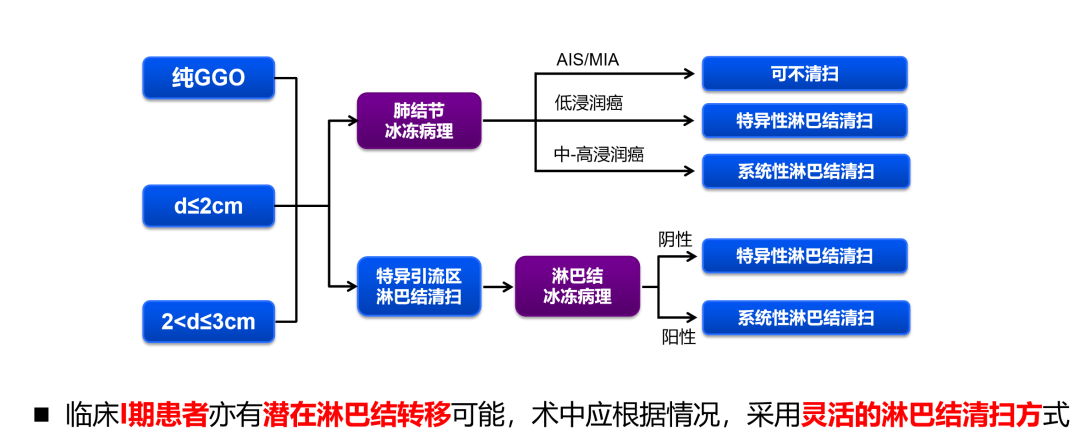
-展望與探索:早期 NSCLC 綜合治療的預測因素探索-
隨著治療理念的更新和發展,早期 NSCLC 的預後預測因素也在逐漸增多。高樹庚教授結合國內外研究進行瞭介紹。
1
t-DNA、MRD 對早期 NSCLC 患者預後具有預測效能:
針對 ctDNA 的英國大型前瞻性隊列研究 TRACERx 提示 ctDNA 濃度可作為預後預測指標,對於腺癌患者的 2 年 OS 率,ctDNA 陰性組:低拷貝組:高拷貝組為 90%: 63%: 24%,P = 5 x 10-6。即使在 IA 期患者中,外界治療也會顯著降低血中 ctDNA 濃度。
高樹庚教授團隊開展的納入 103 例肺癌患者的回顧性研究顯示,ctDNA 陰性組非輔助治療獲益不顯著,而 ctDNA 陽性組,非輔助治療獲益顯著(p = 0.01)。總體表明 ctDNA 對於淋巴結陽性患者預後具有預測效能,未來可選用敏感性和特異性更好的技術監測 I 期肺癌的復發轉移。
吳一龍教授團隊開展的前瞻性研究納入瞭 IA 期 104 例(39.8%),IB 期 53 例(22.6%)患者,研究結果顯示,I 期 NSCLC 中,腫瘤微殘留監測(MRD)對於術後復發的陽性預測值(PPV)為 85.0%,陰性預測值為(NPV)為 98.5% 和 II/III 期效力可比;I 期患者術後 MRD 陽性組預後顯著差於陰性組。
劉倫旭教授團隊開展的納入 330 例早期肺癌患者(67.0% 為 I 期)的前瞻性研究顯示,MRD 陽性對於 I 期及 II-II 期患者的預後區分效果優異。
2
輔助治療或可帶來新改變
2022 年 ESMO 更新的數據提示,與安慰劑相比,IB 期患者能夠從奧希替尼輔助治療中獲益奧希替尼組 vs. 安慰劑組 4 年 DFS 率為 80% vs 60%,HR 0.44。
隨機、開放、對照、前瞻性、單中心 II 期臨床試驗 CORIN 研究提示埃克替尼組的 DFS 較觀察組顯著延長,HR 0.2 (95%CI 0.04-0.89) P = 0.018;兩組的 3 年 DFS 率分別為 95.3% 和 86.7%,但目前 OS 數據尚不成熟。
3
術後隨訪間隔對早期肺癌預後影響不大
美國華盛頓大學的回顧性研究納入瞭 6171 例 I 期(7th) NSCLC 手術患者,按照隨訪頻率將患者分為高頻隨訪組(每年隨訪 22 次,N = 3047)和低頻隨訪組(每年隨訪 <2 xss=removed>
要點總結:
肺癌發病率上升,早篩方法不斷成熟,導致早期肺癌絕對數量不斷攀升,成為胸外科醫生工作的主要部分。相當一部分人預後不良,未被滿足的臨床需求大;
實體-微乳頭成分是預後不良的主要病理學因素,磨玻璃成分是預後好的因素,未來 TNM 分期可能將磨玻璃成分剔除;結節代謝程度也是預後因素之一;
亞肺葉切除對於早期肺癌預後無明顯不良影響,APL 術式安全、可推廣療效好,早期肺癌的淋巴結清掃應靈活掌握;
MRD 在早期肺癌檢出率低,但預測效能較高,未來可采用更敏感和特異的方法進行 l 期肺癌復發轉移的監測;
對於驅動基因陽性的早期肺癌患者亦可考慮術後輔助靶向藥物治療;
早期肺癌術後隨訪間隔可適當拉長,回顧性數據表明可能對患者預後無不良影響。
Nina;編輯:HUan;排版:樂樂



發表評論 取消回复