抗體藥物偶聯物(ADC)是近年來抗腫瘤治療的明星藥物。通過抗體攜帶細胞毒藥物,精準靶向腫瘤細胞並直接殺死腫瘤細胞。
目前,HER2、Trop-2 等靶點已有成熟的 ADC 產品,給血液腫瘤、乳腺癌患者帶來瞭新的治療希望。然而,仍有許多實體瘤,如肺癌,亟待更多新藥研發以提供新的治療手段。
值得一提的是,中國創新藥在 ADC 領域持續發力,已經達到世界領先水平。本次美國臨床腫瘤學會(ASCO)年會,中山大學腫瘤防治中心張力教授帶來一項國產 first-in-class EGFRxHER3 雙特異性 ADC 的首項人體 I 期臨床研究 「BL-B01D1, a first-in-class EGFRxHER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic solid tumor: Results from a first-in-human phase 1 study.」(摘要號:3001)。丁香園腫瘤時間 「2023 ASCO 中國之聲 」 欄目特邀張力教授就研究成果進行精彩解讀。

張力教授在 ASCO 口頭匯報現場

國產創新雙靶 ADC I 期結果公佈
BL-B01D1 是具有抗腫瘤活性的重組人源化 ADC 藥物,一方面可同時結合腫瘤細胞上的 EGFR 和 HER3,實現對兩個腫瘤相關靶點的同時阻斷,以此獲得靶向性和增強的抗腫瘤活性。張力教授表示,「 目前在研 ADC 大多數是靶向單一靶點。BL-B01D1 的突出優勢在於可同時靶向 EGFR、HER3,精準殺滅腫瘤細胞。且這兩個靶點在實體瘤中發生率較高,可覆蓋更多人群。」
本次研究主要納入瞭 195 例經標準治療失敗後的局部晚期或轉移性實體瘤患者,包括 EGFR 突變陽性和 EGFR 野生型非小細胞肺癌、頭頸部腫瘤、鼻咽癌。其中,經過三線及以上治療的患者占比超過 50%。
入組患者分別使用 0.27、1.5、3.0 mg/kg QW、2.5、3.0、3.5 mg/kg D1、D8 Q3W 或 4.5、5.0、6.0 mg/kg D1 Q3W 的 BL-B01D1 治療。一部分 Q3W 的患者進入劑量擴展組。
結果顯示,劑量限制性毒性(DLT)在 3.0 mg/kg 和 3.5 mg/kg D1、D8 Q3w 治療組發生,包括中性粒細胞減少癥、發熱性中性粒細胞減少癥、血小板減少。最大耐受劑量(MTDs)為 3.0 mg/kg D1、D8 Q3W 和 6.0 mg/kg D1 Q3W。常見的治療相關不良反應(TRAEs)包括白細胞減少、中性粒細胞減少、貧血、血小板減少、脫發、惡心、虛弱、食欲減退、厭食、腹瀉、口腔潰瘍、皮疹。未觀察到間質性肺病(ILD)。
張力教授指出,從安全性和有效性綜合考慮,BL-B01D1 的RP2D推薦劑量為 2.5 mg/kg D1、D8 Q3W。
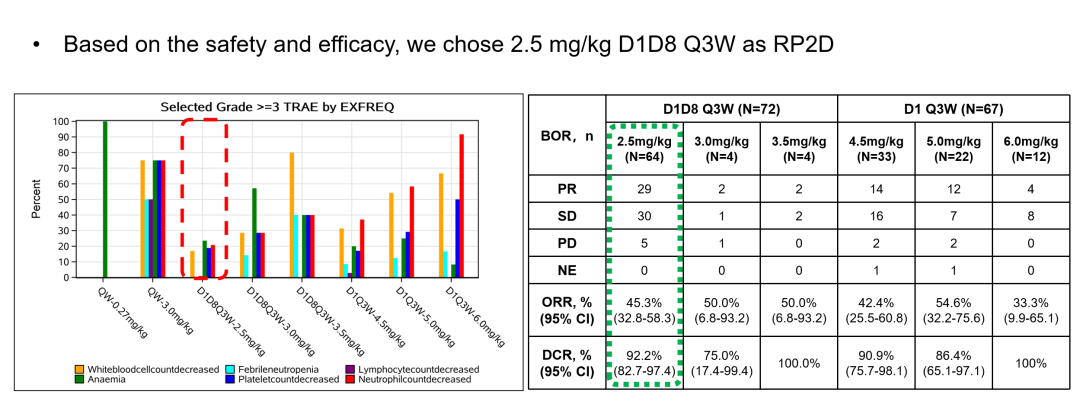
圖1. BL-B01D1臨床試驗二期推薦劑量(RP2D)
張力教授表示,「 包含本研究的各腫瘤的總有效率(ORR)為 45.3%,中位隨訪時間為 4.1 個月,PFS 尚未達到。安全性方面,導致停藥或不能耐受的不良事件(AE)發生率為 3%,劑量下調發生率約為 25%。目前未發現因藥物治療引起的間質性肺炎。」
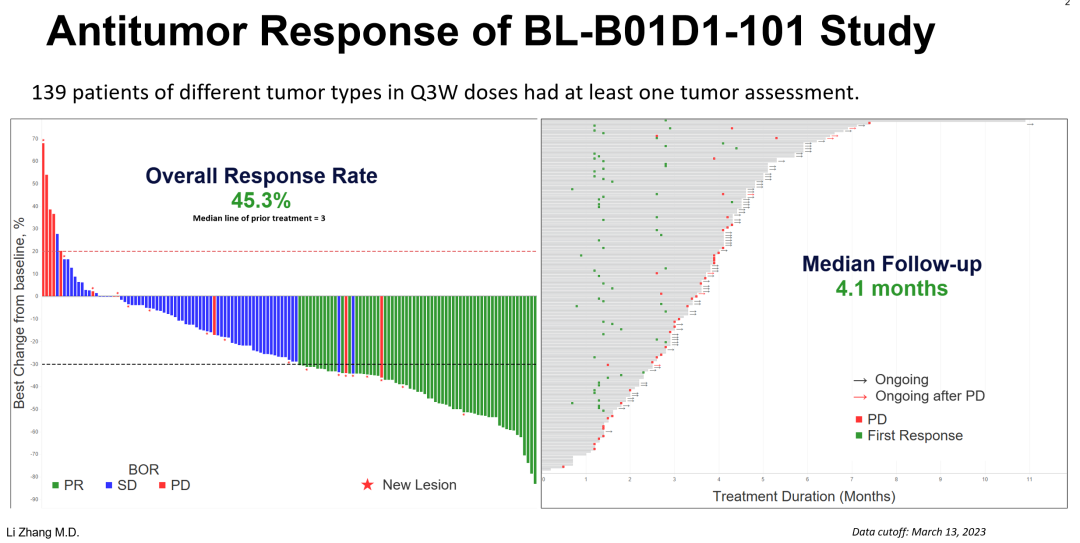
圖2. BL-B01D1總體抗腫瘤反應
「 在 38例EGFR 陽性 NSCLC 患者中,其中有34例患者曾接受過三代 EGFR-TKI 治療後耐藥,整體ORR 可達到 63.2%;EGFR 野生型 NSCLC 患者組的 ORR 為 44.9%;鼻咽癌組 ORR 為 53.6%。小細胞肺癌、頭頸部腫瘤的入組病例較少,ORR 相對較低。」
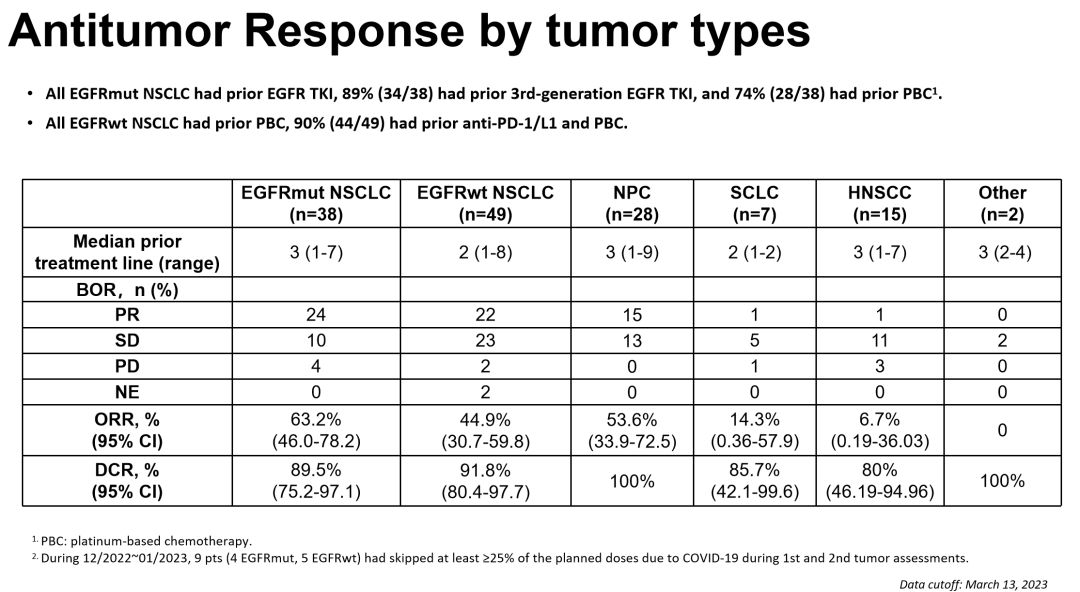
圖3. 根據不同腫瘤類型分層的BL-B01D1抗腫瘤反應
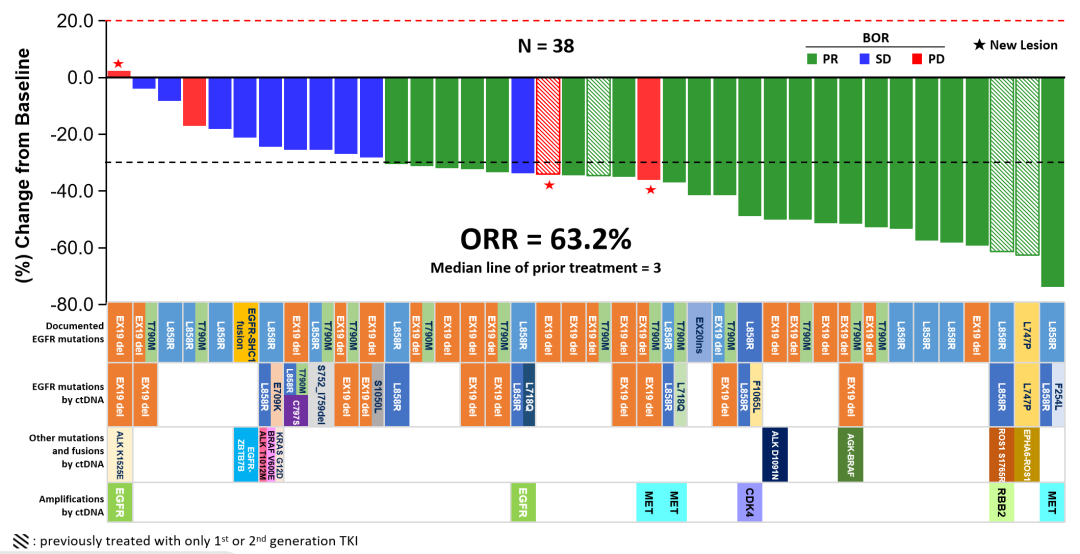
圖4. 不同EGFRmut類型NSCLC的BL-B01D1抗腫瘤反應
獨特機制,或可突破 EGFR-TKI 的耐藥問題
BL-B01D1 在機制上也有其特殊性,BL-B01D1 采用 AC linker 將喜樹堿衍生物 ED04 連接到抗體的半胱氨酸位點,可以針對 EGFR 依賴腫瘤靶向殺傷、預防 HER3 引起的耐藥的同時實現對腫瘤細胞的精確殺傷,減少小分子毒素對人體正常細胞的破壞。
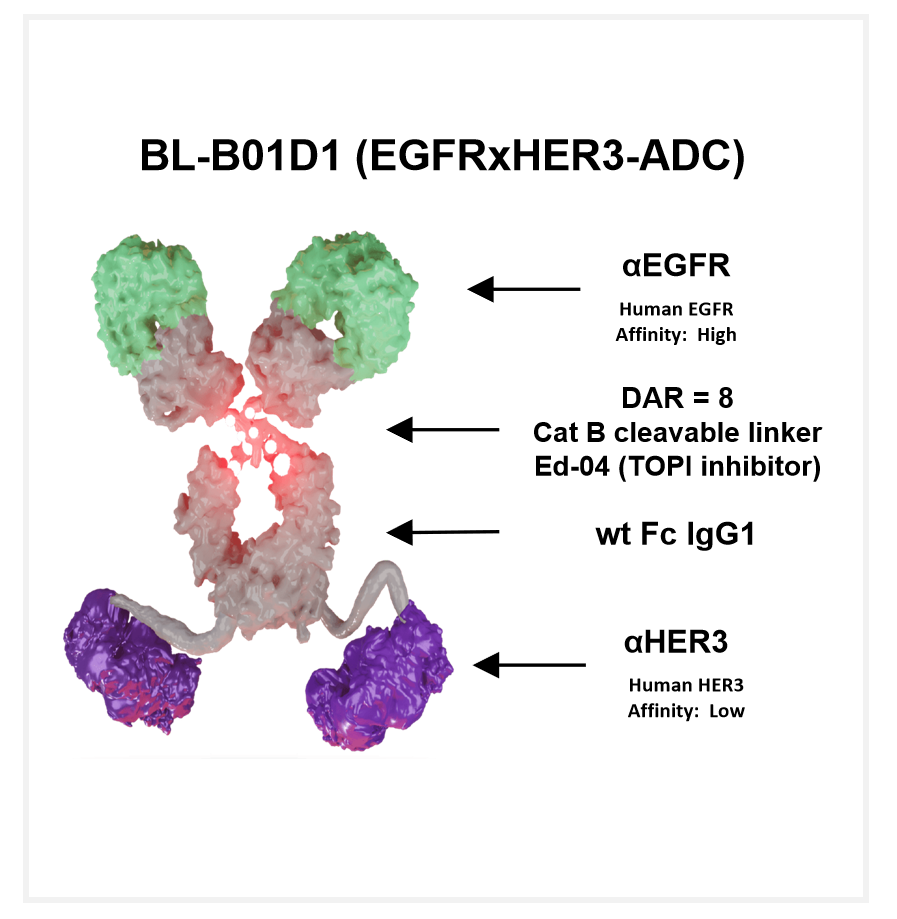
圖5. BL-B01D1是靶向EGFRxHER3的雙抗ADC
EGFR 突變陽性在 NSCLC 中發生率較高,靶向藥物提供瞭較好的治療效果。但三代 EGFR-TKI 耐藥後,由於耐藥機制多樣,缺乏較好的治療應對手段。BL-B01D1 可有效解決 EGFR-TKI 耐藥問題。張力教授指出,BL-B01D1 的作用機制是細胞毒藥物殺滅腫瘤,因此,不受耐藥機制影響。
總體來說,BL-B01D1 在治療 EGFR 陽性肺癌、EGFR 野生型肺癌以及鼻咽癌中的療效可觀,目前 III 期臨床試驗也正在準備中。
即將申請突破性療法,盡快惠及臨床廣大患者
既往 I 期臨床試驗的主要目標是探索藥物的安全性以及最適合的 II 期劑量。張力教授表示,通常 DLT 的觀察期為 1 個月,但臨床使用時患者不僅使用一個月,因此 DLT 存在一定局限性。
近期,國傢藥品監督管理局藥品評審中心(CDE)、美國食品藥品監督管理局(FDA)提出,在 I 期臨床試驗中除瞭進行安全性、有效性探索,還應當進行劑量優化。因此,I 期臨床研究規模已經進一步擴大。
張力教授分享 BL-B01D1 臨床研究設計的經驗:「 最初開始設計每周給藥組劑量爬坡時,第三個劑量級就開始出現瞭 DLT。因此隻能進行劑量下調,同時改變給藥方式,即改為 D1、D8 給藥,但在第四個劑量級再次出現 DLT。隨後從每周給藥改為每三周給藥。」
「 由於 I 期臨床試驗有瞭新要求,未來不但要關註最大耐受劑量和劑量限制性毒性,還應當觀察不同給藥方式、優化給藥劑量和劑量擴展。這是一種新的臨床試驗設計模式,即將 I、II 期聯合在一起進行無縫設計,可能馬上開啟 III 期臨床研究。」
「 目前,BL-B01D1 臨床研究仍在進行中,未來擴展一部分患者後將會直接申請突破性療法。通過無縫 I/II 期試驗,完成劑量探索、劑量爬坡、劑量擴展、有效性探索。通過這一路徑,可以節省整個新藥開發的流程,盡快將好的創新藥推及臨床,造福廣大患者。」
作者:sweet;審核:張力教授
編輯:Huan;排版:樂樂




發表評論 取消回复