結直腸癌是中國常見的惡性腫瘤之一,約 30% 的結直腸癌患者在確診時已出現遠處轉移。EGFR-RAS-RAF-MAPK 通路是結直腸癌靶向治療中的重要通路。靶向 EGFR 的代表藥物西妥昔單抗最早於 2004 年在美國被批準用於晚期結直腸癌的治療,並於 2006 年首次在國內獲批用於晚期結直腸癌的治療,很大程度改變瞭晚期結直腸癌的治療格局。但近年來,靶向治療新藥進展緩慢,繼發耐藥也大大限制瞭靶向藥物的臨床獲益。
第十三屆北京消化腫瘤國際高峰論壇暨中國胃腸腫瘤臨床研究協作組(CGOG)第十三屆年會於 2023 年 6 月 7-11 日在北京順利召開。結直腸癌分會場中,北京大學腫瘤醫院王晰程教授以「結直腸癌 EGFR 信號傳導通路治療策略差異及前景」為題進行瞭精彩的報告。

王晰程教授聚焦 EGFR 通路及旁路上的 3 個重要靶點:HER2 擴增,KRAS G12C 和 BRAF V600E,深入探討瞭目前結直腸癌靶向治療現狀和 EGFR 通路耐藥機制,並對結直腸癌靶向治療的未來進行瞭展望。丁香園腫瘤時間將其內容整理總結如下:
HER2 擴增
HER2 擴增發生在 3%-5% 的結直腸癌中,主要富集於 KRAS/NRAS 野生型的左半結腸癌患者。
總結目前抗 HER2 雙靶治療在結直腸癌三線及以上治療的研究數據,客觀有效率(ORR)大致在 30%-50%,無進展生存期(PFS)約 4-6 個月。
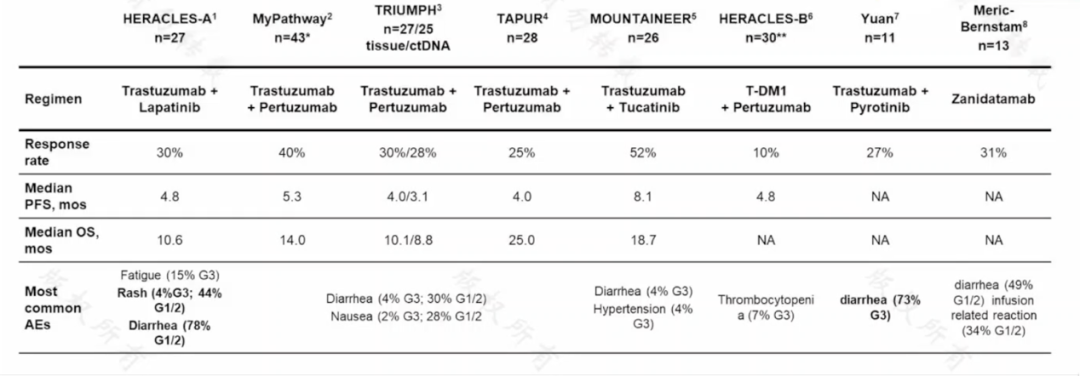
圖 1:抗 HER2 雙靶治療在結直腸癌中的研究數據
近年來備受關註的 ADC 類藥物 DS-8201 在結腸癌中也有探索。DESTINY-CRC01 結果表明轉移性結直腸癌中 ORR 約 45.3%,PFS 約 6.9 個月。但值得註意的是,約有 3% 的患者出現瞭嚴重的藥物性肺損傷,這為腫瘤科大夫應用該藥帶來諸多挑戰。與免疫治療停藥後仍有持續應答不同,ADC 類藥物作為靶向聯合化療的抗體藥物偶聯物,發生嚴重不良反應後停藥往往會導致腫瘤快速進展。
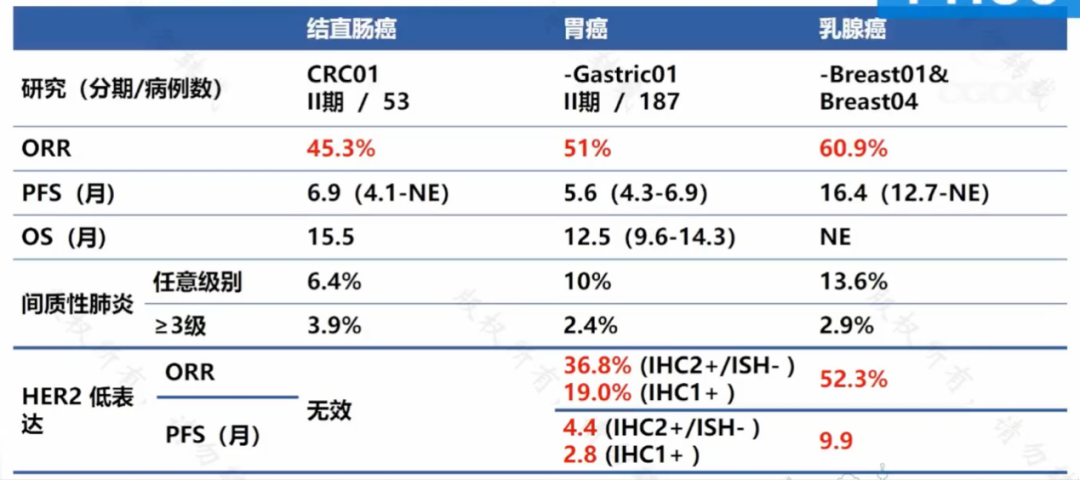
圖 2:DS8201 在各瘤種中的研究數據
而今年 ASCO 會議上發佈的 DESTINY-CRC02 研究相較 CRC01 研究帶來瞭兩處驚喜:
1
CRC02 研究嘗試減少瞭 ADC 類藥物劑量(6.4 mg/kg 減至 5.4 mg/kg),發現減量並不影響藥物療效,而安全性更有保障。
2
既往傳統抗 HER2 靶向藥使用范圍限制在 RAS 野生型的患者,而有 HER2 擴增同時下遊存在 RAS 突變的人群(大約占 1%)不適合傳統的抗 HER2 治療。CRC02 特意入組瞭下遊存在 RAS 突變的患者,結果發現這部分人群使用 ADC 類藥物有效率近 30%。
盡管抗 Her2 靶向治療在三線以上的結直腸癌治療中取得瞭部分成果,但有效率仍欠滿意。王晰程教授團隊也在積極探索靶向藥物的基礎上聯合化療以及將治療前移的方案。
王晰程教授分享瞭一例 54 歲的乙狀結腸癌肝轉移男性患者,一線使用 XELOX 聯合貝伐珠單抗治療 2 周期後評估 SD,肝臟病灶縮小不明顯。NGS 提示 MSS 型,KRAS/NRAS/BRAF 全野生型,HER2 擴增 CNV 9;免疫組化提示 HER2 3+。考慮初始化療有效,肝內病灶潛在可切除,且 HER2 高表達陽性,故改換治療為 XELOX 聯合曲妥珠單抗和帕妥珠單抗治療,6 周期後腫瘤明顯縮小,後續肝膽外科術中探查發現 17 枚病灶,14 枚切除、3 枚消融,病理提示全部達到 pCR 以上的療效。提示瞭靶向聯合化療的良好前景。
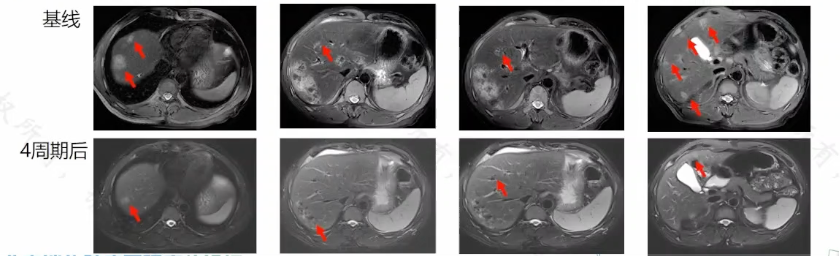
圖 3:該患者使用雙靶+化療方案前後病灶對比
MOUNTAINEER 研究也正在探索 mFOLFOX6 聯合 Tucatinib 與曲妥珠單抗雙靶治療對比標準化療在一線治療 HER2 陽性轉移性結直腸癌患者中應用,該研究目前正在北京大學腫瘤醫院開展入組,期待後續的研究結果。
隨著免疫治療成為腫瘤治療的焦點,聯合免疫治療也是探索的熱門方向。KEYNOTE811 研究已經證實靶向聯合化療基礎上加用免疫治療在 HER2 陽性胃癌中的應用效果。但「靶向+免疫+化療」的聯合模式在 HER2 陽性結直腸癌患者中是否有效尚不明確。
既往研究發現全野生型的左半結腸癌通常會落入結直腸癌共識分子亞型(CMS)中的 CMS2 型(經典型)。北京大學腫瘤醫院許婷博士的研究工作也發現 HER2 擴增的結直腸癌免疫微環境表現為免疫荒漠樣表型。因此王晰程教授認為:單純在靶向基礎上聯用免疫治療可能效果不佳。如何改變荒漠型的免疫微環境、設計更好的臨床研究、是未來的研究方向。
KRAS G12C
KRAS G12C 在結直腸癌中突變率約 3%。在化療時代,KRAS G12C 並非轉移性結直腸癌的預後因子。但隨著 KRAS G12C 抑制劑的開發,部分研究也開始探索靶向該位點的治療方案。其中 KRYSTAL-1 研究提示 KRAS G12C 抑制劑聯合西妥昔單抗可以延長 PFS 和 OS,PFS 大致 6 個月。
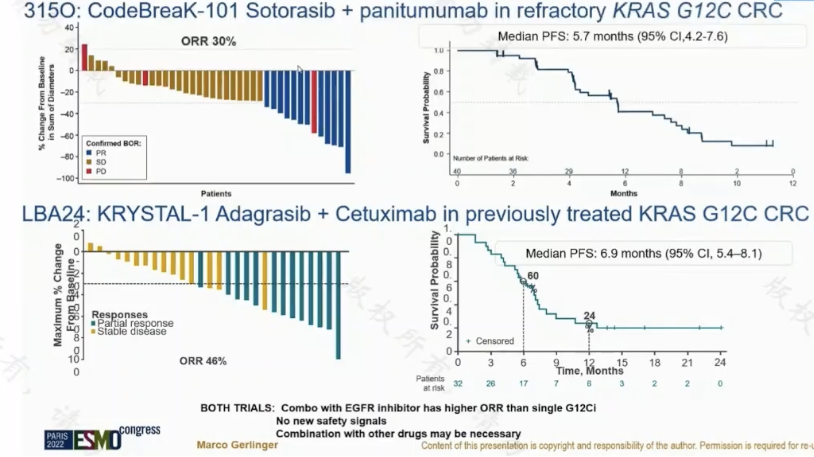
圖 4:結直腸癌 KRAS G12C 靶向治療
BRAF V600E
BRAF 靶向治療在結直腸癌中的應用方面,BEACON 研究奠定瞭雙靶治療(BRAF 抑制劑 encorafenib 聯合西妥昔單抗)在 BRAF V600E 突變的轉移性結腸癌中二線應用的地位,ORR 約 20%,PFS 約 4 個月。
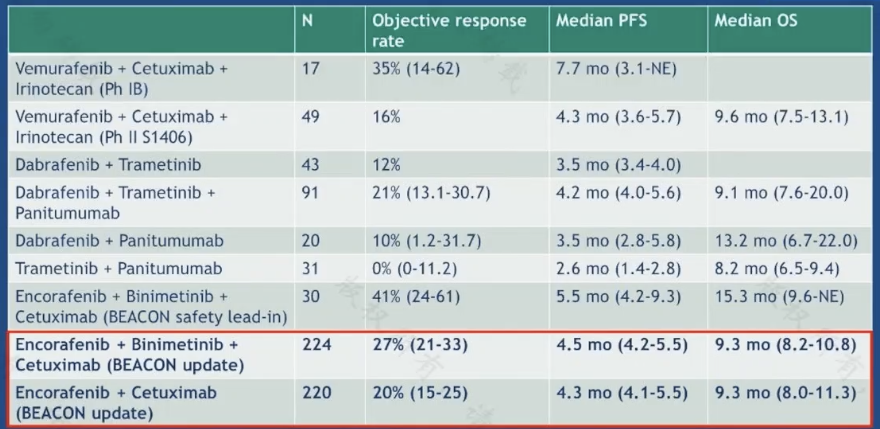
圖 5:結直腸癌 BRAF 靶向治療
與抗 HER2 靶向治療的探索類似,研究者們也在積極探索將抗 BRAF 靶向治療前移,以及靶向聯合化療是否可以為患者帶來更多獲益。ANCHOR 研究旨在探索雙靶方案(encorafenib 和 binimetinib)聯合西妥昔單抗一線治療 BRAF V600E 突變的轉移性結腸癌患者的療效,今年發佈的長期隨訪結論顯示 PFS 約 5.8 個月。目前正在進行的 BREAKWATER 研究選用 encorafenib 聯合西妥昔單抗聯合化療(mFOLFOX6 或 FOLFIRI),期待未來的研究結果。
另外關於 BRAF 療效預測標記物的研究也正在開展。RNF43 基因富集於 BRAF V600E 突變型結直腸癌,參與鋸齒狀通路結直腸癌的發生發展,RNF43 基因突變與 EGFR/BRAF 靶向治療臨床獲益相關,因此可能作為一個有效的療效預測因子。
王晰程教授提到:無論是靶向 HER2、KRAS G12C 或是 BRAF V600E 位點的探索,目前數據中 ORR 大致為 20%~50%,而 PFS 基本為 6 個月左右。換言之,多數患者會在半年內出現疾病進展。如何使患者獲得長久的緩解,是結直腸癌靶向治療應當討論的重要話題。
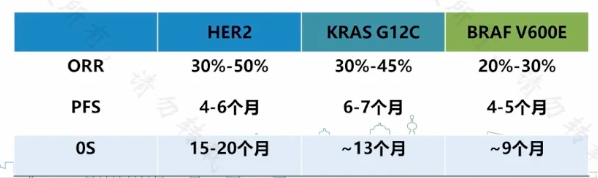
圖 6:HER2 擴增/KRAS G12C/BRAF V600E 雙靶治療有效率
結直腸癌 EGFR 通路靶向治療繼發耐藥機制
研究發現上述通路靶向治療的繼發耐藥機制存在相似之處,主要是通路下遊或旁路的基因突變或擴增(如 RAS 繼發突變、cMET 擴增等)所致。
王晰程教授團隊的研究發現,與肺癌中單位點的繼發突變不同,腸癌中往往會出現多個亞克隆的耐藥突變(下圖 no.17 患者在使用 BRAF 抑制劑後出現瞭多個耐藥基因突變),這導致很難通過使用單一的靶向藥物逆轉耐藥。
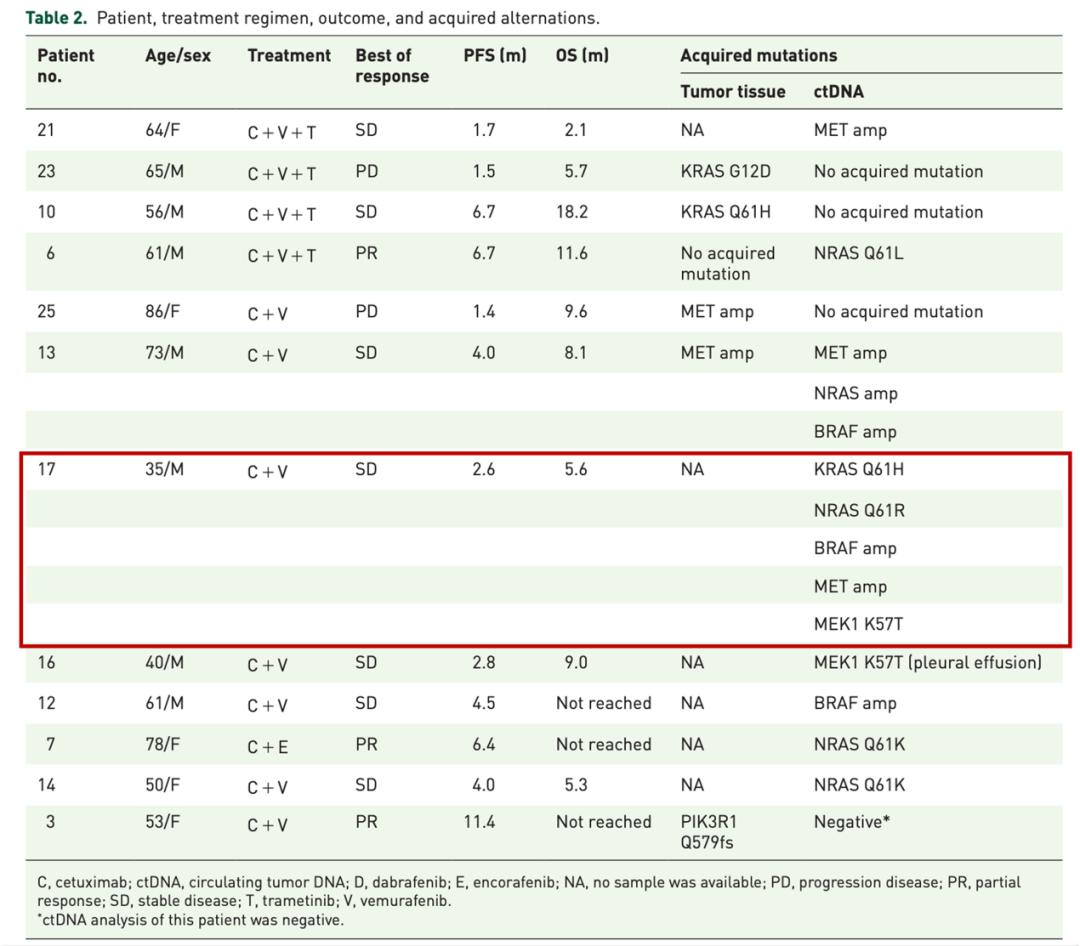
圖 7:CET+BRAFi 耐藥機制研究
一篇今年發表在 Cancer Discovery 上的文章探索瞭 KRAS G12C 抑制劑聯合 EGFR 抑制劑治療的耐藥機制,發現除瞭下遊通路繼發的低頻、亞克隆性突變外,KRAS G12C 的拷貝數穩健上升。既往研究者寄希望於下遊通路繼發的擴增隨時間衰減後進行靶向治療再挑戰,但本研究的結論發現 KRAS G12C 的拷貝數的擴增通過影響 mTOR 通路等,導致再挑戰仍然效果不佳。
借鑒其他瘤種的經驗,一篇黑色素瘤的文章發現 BRAF/MEK 抑制劑會造成基因組不穩定,提示 PARP 抑制劑可能改善甚至逆轉耐藥。
2023 年 ASCO 會議上報道瞭關於 SHP2 抑制劑探索結果。既往臨床前研究和早期臨床研究中單藥 SHP2 抑制劑的有效率均不理想,但該研究發現 SHP2 抑制劑與其他靶向治療聯合在 ALK 融合的非小細胞肺癌、BRAF V600E 突變的結直腸癌以及 KRAS G12C 突變的胰腺癌中均有可觀的療效。
值得關註的是,該研究中有一位 BRAF V600E 突變的結腸癌患者,在康奈非尼聯合西妥昔單抗耐藥後入組該研究。在前 6 周單藥使用 SHP2 抑制劑時腫瘤並未控制,但後續再次加用雙靶治療後達到瞭 PR 並維持近半年的療效。提示在腸癌中聯合使用 SHP2 抑制劑可能是一個值得探索的方向。
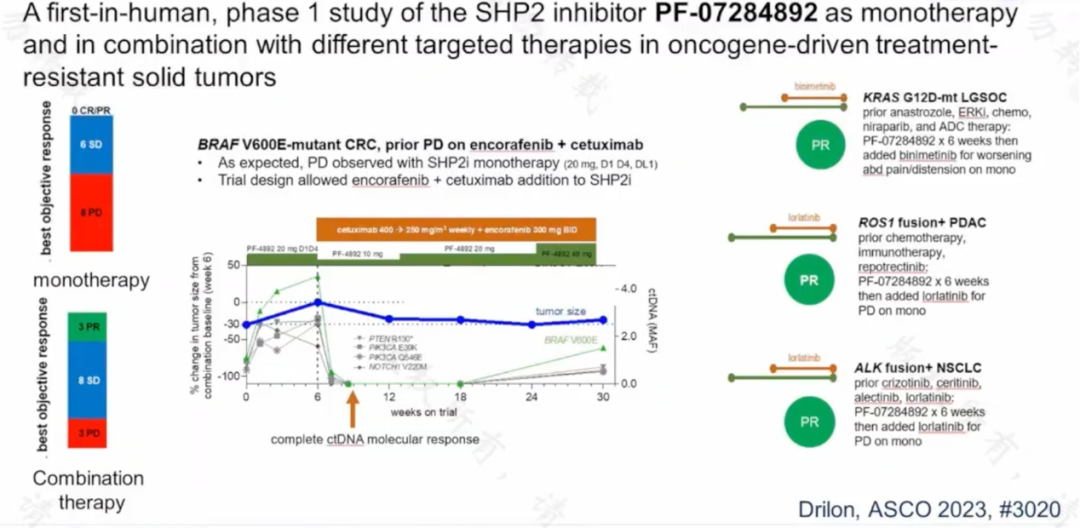
圖 8:SHP2 抑制劑聯合靶向治療
總結與思考
王晰程教授總結,腸癌中針對 HER2、KRAS G12C、BRAF V600E 等靶點的靶向治療雖然有效率尚可,但繼發耐藥往往在半年左右出現,療效難以轉化為長期獲益。
回首 EGFR 單抗西妥昔單抗的成功經驗,最初西妥昔單抗獲批三線治療,客觀有效率僅 10%,但後續將其應用前移,PARADIGM 研究表明一線使用西妥昔單抗聯合化療治療可將有效率提升至 80%,PFS 時間超過一年以上。因此聯合化療、治療前移可能是提高療效的手段之一,期待 MOUNTAINEER 研究和 BREAKWATER 研究能夠帶來驚喜,重復西妥昔單抗的精彩。
而積極開展臨床前研究,對於耐藥機制進行更深入的探索,挖掘更多的靶點和通路組合進行臨床研究設計,也應當是臨床醫生應當思考和探索的方向。
本文首發於丁香園旗下專業平臺:丁香園腫瘤時間
整理:華雨薇;審核:王晰程教授
插圖:王晰程教授講課 PPT 截圖
排版:林舒雅;題圖:站酷海洛





發表評論 取消回复