18日,礼来多奈单抗注射液(Donanemab)国内正式获批,用于治疗成人因阿尔茨海默病(AD)引起的轻度认知功能障碍和阿尔茨海默病轻度痴呆。

图源:礼来
在美上市仅 5 个月后,全球第二款 AD 新药登陆中国,同时它也是第一款且唯一一款有证据支持,在清除淀粉样蛋白斑块后可停药的靶向淀粉样蛋白的疗法。
每月 1 针,针对淀粉样斑块,还不用终身服药
Donanemab 是一种抗淀粉样蛋白单克隆抗体,可与 β 淀粉样蛋白亚型 N3pG 结合,促进 AD 患者大脑中淀粉样蛋白斑块的清除。该药每 4 周静脉输注一次,前三次剂量为 700mg,随后为 1400mg。
5 个月前,Donanemab 在美获批,用于已明确淀粉样蛋白病理的轻度认知障碍患者和轻度痴呆阶段的 AD 患者。同时,Donanemab 也是第一款且唯一一款针对淀粉样斑块的治疗方法。
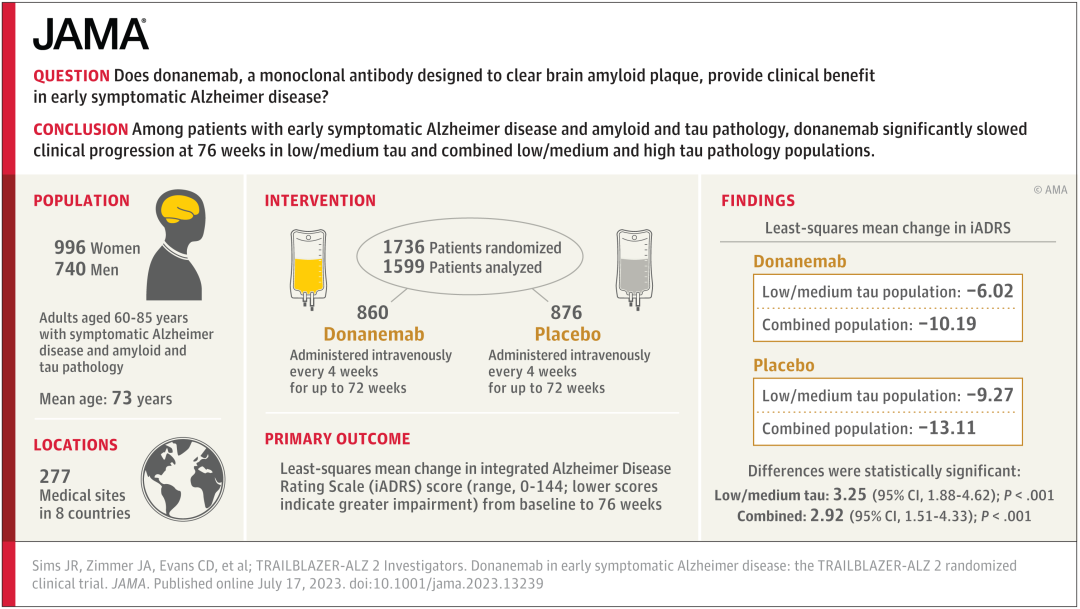
2023 年 7 月 17 日,礼来公司公布了 III 期研究完整结果,显示该药显著减缓了早期症状性 AD 患者的认知和功能衰退。

clinicaltrials.gov 截图
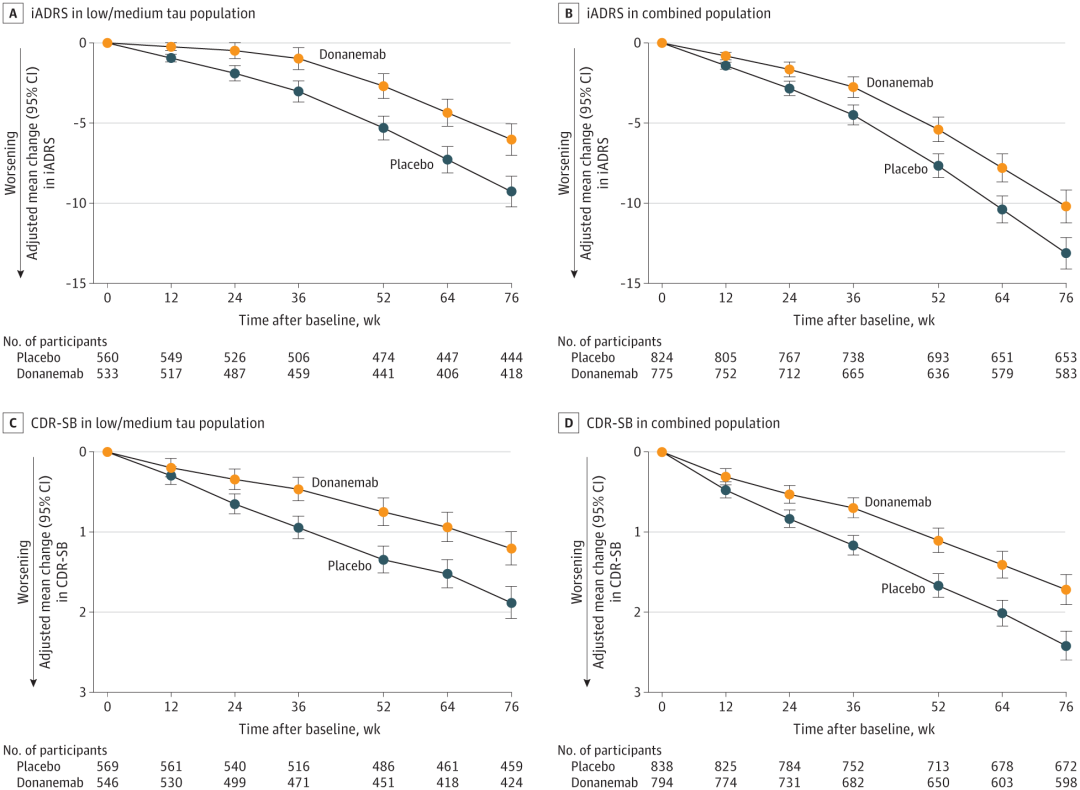
试验在淀粉样蛋白阳性的基础上,根据脑内 tau 蛋白水平将患者分组,在 18 个月内使用 AD 综合评分量表(iADRS)、临床痴呆评定量表(CDR-SB)等多个量表进行认知和功能评估。
参与者以 1:1 的比例随机分配接受 Donanemab(n = 860)或安慰剂(n = 876),每 4 周接受一次 30 分钟静脉输注,共 72 周。淀粉样蛋白清除率达标后,donanemab 组的参与者在盲法下改用安慰剂。
试验结果显示,在低-中 tau 蛋白水平患者中,Donanemab 治疗组在 iADRS 得分上衰退减缓 35%,在 CDR-SB 上衰退减缓 36%。在所有淀粉样蛋白阳性的早期症状 AD 患者中,Donanemab 治疗组在 iADRS 上衰退减缓 22%,在 CDR-SB 上衰退减缓 29%。
图源:资料 1
无论基线病理阶段如何,Donanemab 治疗均可显著降低淀粉样斑块水平。在所有参与者中,使用 Donanemab 治疗 18 个月后,淀粉样斑块平均减少了 84%,而使用安慰剂的参与者减少了 1%。
而且,该药无需终身用药。参与者在临床试验固定阶段检查达到淀粉样斑块清除的预定标准,便可以停止服用药。大约一半的参与者 12 个月就达标了,18 个月时达标患者达到七成,Donanemab 组患者进展到下一临床阶段的风险也降低了 39%。
如果不看斑块看认知,与安慰剂组相比,该药能让患者认知衰退水平平均延缓 7.5 个月(使用 CDR-SB 评估)。
图源:资料 1
争议之下的全球首款
AD 的病因时至今日仍未完全阐明,药物研究也因此颇为曲折,本世纪前 20 年失败率一度高达 99%,有 200 多种候选药物临床试验先后失败,被称作「死亡之谷」[2]。
时至今日,AD 具体病因尚未完全阐明。目前延缓患者病情的制药思路,主要是针对其明确的病理特征,即 AD 患者的大脑出现 β 淀粉样蛋白斑块沉积、tau 蛋白异常磷酸化和神经纤维缠结形成。
Donanemab 的上市之路,从侧面充分体现了 AD 病因和发病机制争议的旷日持久。
早在 2021 年 1 月,礼来公司就已宣布顺利地完成 II 期临床试验 。当年 10 月,礼来公司宣布已基于上述研究结果启动了 Donanemab 用于早期阿尔茨海默病加速批准的滚动程序。

图源:资料 3
然而到了 2023 年 1 月,FDA 突然表示「提交中提供的至少 12 个月药物暴露数据的患者数量有限」,需提供至少 100 名患者数据。
于是,礼来在 4 个月后完成了上述 III 期临床试验,并再次递交上市申请。
按原计划,FDA 将在 2024 年一季度审议决定,但由于「若干核心问题还需讨论」,FDA 表示还需召开专门委员会会议。
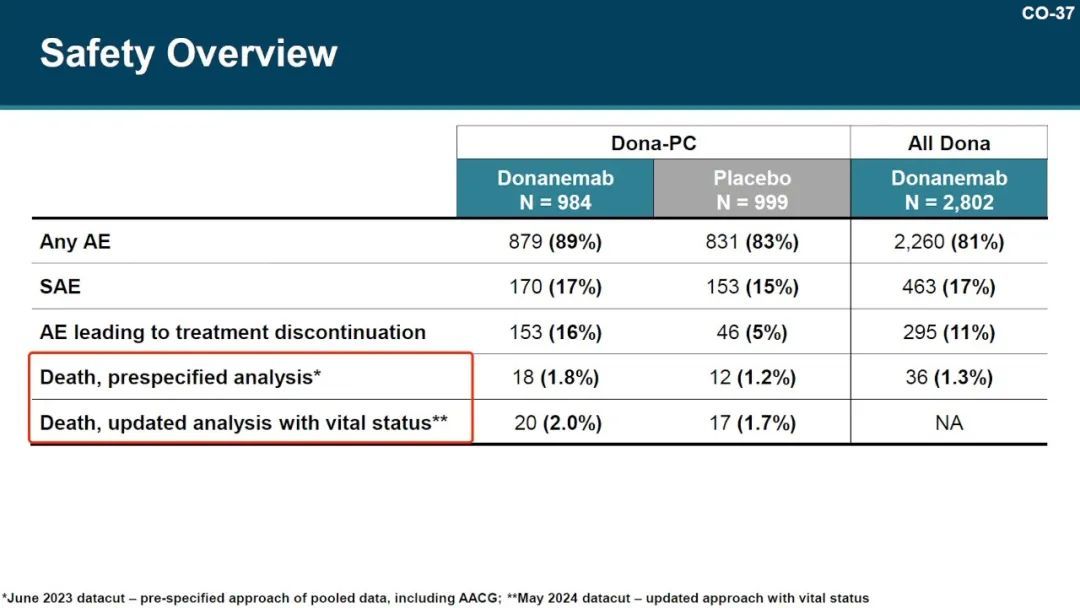
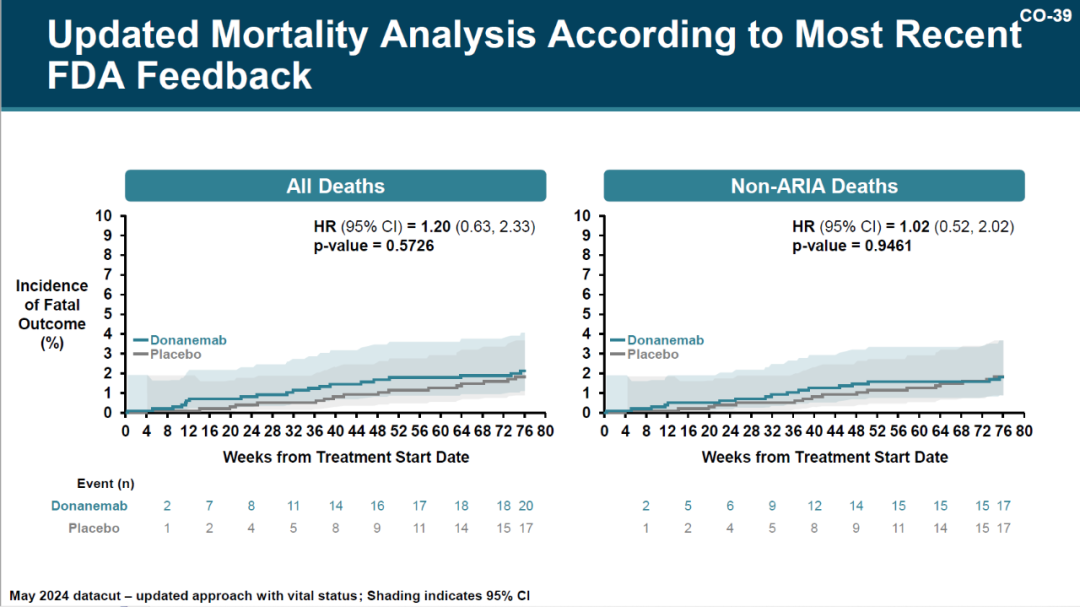
彼时业内人士透露,FDA 要求礼来公司收集提前终止临床试验受试者的存活状况,于是此后安全数据有了更新:Donanemab 组和安慰剂组的死亡率分别从 1.8% 和 1.2% 更新为 2.0% 和 1.7%
图源:资料 4
与其他同类药物类似,淀粉样蛋白相关影像异常 (ARIA)为重要的不良事件,在 Donanemab 组比安慰剂组更高(31.4% vs 13.6%)。Donanemab 组中 1.6% 患者因 AIRA 导致严重后果,且 III 期临床试验中有 3 例死亡发生在严重的 AIRA 之后。
当地时间 6 月 10 日,FDA 独立科学顾问委员进行终于进行了投票。委员会以 11:0 的票数一致投票通过,认为当前证据足够表明该药有效、该药益处大于风险。
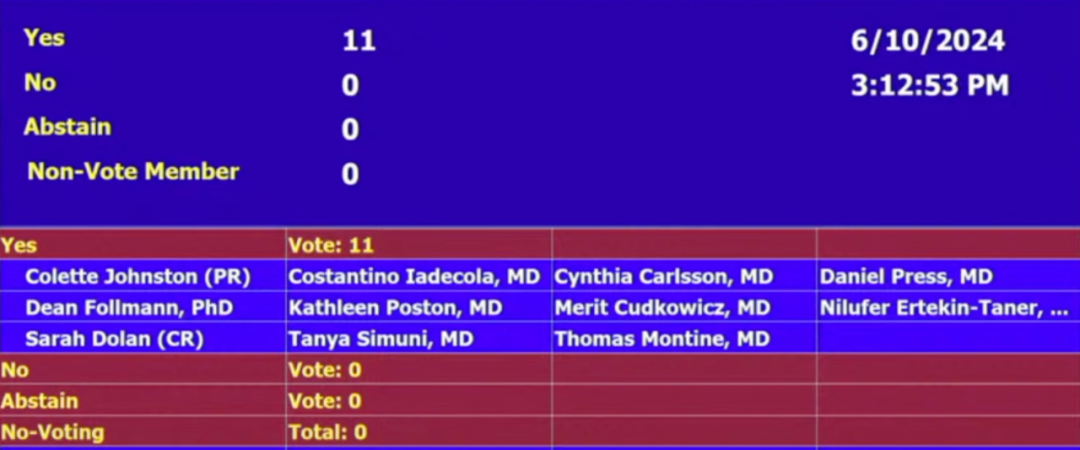
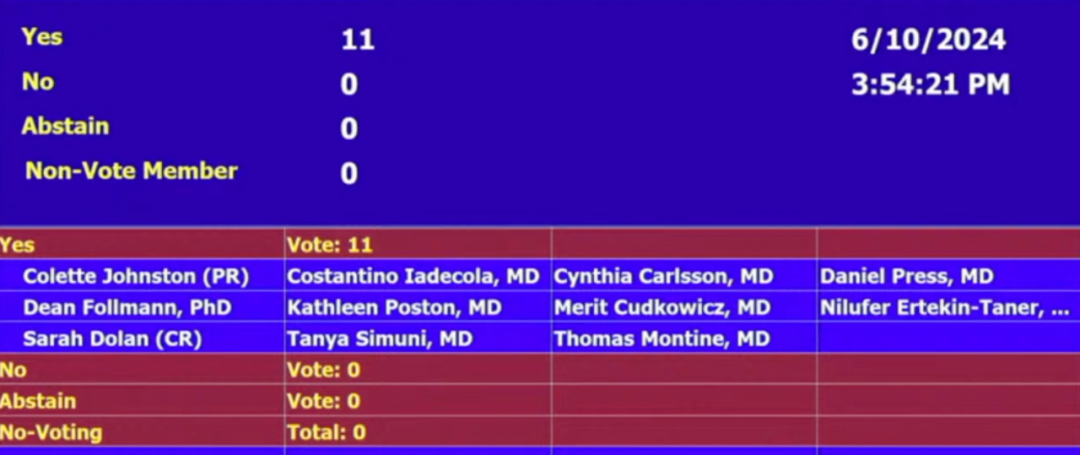
图源:美国 FDA
对于 ARIA,FDA 选择标注黑框警告。与杂合子和非携带者相比,ApoE ε4 纯合子患者的 ARIA 发病率更高。在开始治疗之前,应进行 ApoE ε4 状态检测,评估 ARIA 的风险。
国内获批,患者多了一种选择
在美获批之后,对于使用淀粉样斑块这一生物标志物,而非临床症状作为终点进行的临床试验结果,FDA 是否应该接受其作为上市依据,这一争论一直未能平息。
但争论归争论,全球 AD 患者都迫切需要延缓病情的手段,这也是全球各国审评机构陆续选择支持 AD 新药上市的核心原因。
复旦大学附属华山医院神经内科郁金泰教授认为,近年来陆续上市了两款新药,这是 AD 领域,尤其是 Aβ 靶向的疾病修饰治疗领域的重要突破。
同为 AD 新药,卫材的仑卡奈单抗于今年 1 月进入国内市场,每年治疗费用约 18 万元。在卫材的 2024 财年一季度财报中,中国市场的贡献已经被提及,在正式进入终端渠道前,就为仑卡奈单抗创造了 100 万美元的销售额。
据卫材估算,到 2032 年中国可能成为仅次于美国的第二大市场,届时全球使用该药的患者可达 332 万,中国患者的比例将激增到 28%,中国区销售额占比可涨至 13%,约合人民币 82 亿元 [5]。
这一预期,充分说明了患者对 AD 药物的迫切需求,Donanemab 获批后,势必也将成为这一市场的有力竞争者。
目前,Donanemab 的定价为 695.65 美元/瓶(约合人民币 5067 元/瓶),按此计算 1 年治疗费用约合 23 万元人民币。按照同类药品定价规律,国内上市价格可能会有所下调。

图源:礼来
对于 Donanemab 此番国内上市,郁金泰教授表示期待:「对我国早期 AD 患者而言,这是多了一种能显著延缓他们的疾病进程的全新选择。Donanemab 每月仅使用一次,不仅丰富了现有 Aβ 靶向疗法的药物种类,还为患者及其家属提供了较高的便利性。」
「临床医生和患者应密切关注这一动态,以为早期 AD 患者争取最佳治疗窗口期。」
策划:云也|监制:islay
参考资料:
[1]Sims JR, Zimmer JA, Evans CD, et al. Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial. JAMA. 2023;330(6):512–527. doi:10.1001/jama.2023.13239
[2]Becker RE, Greig NH. Increasing the success rate for Alzheimer''s disease drug discovery and development. Expert Opin Drug Discov. 2012;7(4):367-370. doi:10.1517/17460441.2012.672409.
[3]Mintun MA, Lo AC, Duggan Evans C, Wessels AM, Ardayfio PA, Andersen SW, Shcherbinin S, Sparks J, Sims JR, Brys M, Apostolova LG, Salloway SP, Skovronsky DM. Donanemab in Early Alzheimer''s Disease. N Engl J Med. 2021 May 6;384(18):1691-1704. doi: 10.1056/NEJMoa2100708. Epub 2021 Mar 13. PMID: 33720637.
[4]https://www.fda.gov/advisory-committees/advisory-committee-calendar/updated-public-participation-information-june-10-2024-meeting-peripheral-and-central-nervous-system
[5]卫材一季度财报




發表評論 取消回复