引言
2022 年全球新增胰腺癌约 51.10 万人,居所有癌症发病率的第 12 位,全球胰腺癌死亡约 46.74 万人,为所有癌症死亡的第 9 位[1]。胰腺癌恶性程度高,死亡率高,5 年生存率约 9%,是名副其实的「癌中之王」,严重威胁人类的生命健康[2]。
如何为胰腺癌制定个体化诊疗方案、改善胰腺癌患者的生存一直是学术研究的重点。2024 年美国临床肿瘤学会(ASCO)年会将于今年 5 月 31 日~6 月 1 日在美国芝加哥盛大召开。日前,大会已公布部分研究的摘要。
「丁香园肿瘤时间」特整理四项胰腺癌领域值得关注的重磅研究,内容涵盖老年患者个体化治疗、术后辅助同步放化疗、人工智能助力治疗决策、早发性胰腺癌的微生物组特征,与你一同学习进步!
重点提炼
①Abstract 4003:EA2186 II 期随机对照试验是首个探索新诊断的转移性胰腺导管腺癌(mPDAC)老年患者最佳治疗策略的前瞻性研究[3]。
②Abstract 4005:NRG Oncology/RTOG 0848 研究证实,术后辅助 5-FU/吉西他滨增敏化疗可改善壶腹周围癌(PA)总人群的无病生存期(DFS)和淋巴结阴性人群的总生存期(OS)和 DFS[4]。
③Abstract 4015:法国学者通过整合临床前模型和机器学习开发了一种基于转录组的综合预测工具,或有助于识别 PDAC 对 FOLFIRINOX 和吉西他滨的敏感性,避免不必要的给药和毒性[5]。
④Abstract 4016:美国学者证实早发性 PDAC(eoPDAC)和平均发病性 PDAC(aoPDAC)具有不同的微生物组学特征,有助于解释 eoPDAC 的发病增多,助力开发基于微生物组的生物标志物[6]。
Abstract 4003
标题:A randomized phase II study of gemcitabine and nab-paclitaxel compared with 5 fluorouracil, leucovorin, and liposomal irinotecan in older patients with treatment naıve metastatic pancreatic cancer (GIANT): ECOG-ACRIN EA2186
ECOG-ACRIN EA2186:一项吉西他滨和白蛋白紫杉醇对比 5-FU、亚叶酸钙和伊立替康脂质体治疗初治转移性胰腺癌老年患者(GIANT)的随机 II 期研究
讲者:美国大通福克斯癌症中心 Efrat Dotan
研究背景
对于新诊断的衰弱的转移性胰腺导管腺癌(mPDAC)老年患者,由于尚缺乏个体化治疗的循证医学数据,故其治疗方案仍基于年轻患者的研究数据来制定。EA2186 是一项 II 期随机对照试验,也是首个旨在为新诊断的 mPDAC 老年患者确定最佳治疗方法的前瞻性研究。
研究方法
EA2186 研究纳入了年龄 ≥ 70 岁、组织学确诊为 mPDAC、ECOG PS 0-2 分且器官功能正常的衰弱患者。衰弱(vulnerability)通过老年评估(GA)筛查定义,即功能状态、合并症、认知的轻度异常或年龄 ≥ 80 岁。
患者被随机分配至 A 组:每 14 天接受吉西他滨(1000 mg/m²)和白蛋白紫杉醇(125 mg/m²);或B组:每 14天 接受 5- 氟尿嘧啶(2400 mg/m²,持续 46 小时),亚叶酸钙(400 mg/m²)和脂质体伊立替康(50 mg/m²),在基线和 3 个时间点完成综合 GA 和生活质量(QOL)评估。
主要终点是总生存期(OS),次要终点包括无进展生存期(PFS)、缓解率(RR)、安全性和 QOL。
本研究使用单侧对数秩检验,在 α = 0.10 显著性水平下,有 90%的功效检测到两组中位 OS 的差异,分别为 7.7 个月 vs.10.7 个月(HR = 0.72)。分层因素包括年龄 70~74 岁 vs. ≥ 75 岁,ECOG PS 0-1 分 vs. 2分,该研究在单次中期分析时符合 OS 预设的无效边界(60.6%置信),并被 DSMC 提前关闭。
研究结果
2020 年 6 月至 2023 年 10 月期间,本研究在美国 92 个中心纳入了 176 名患者,A 组和 B 组各 88 名患者。入组患者的中位年龄为 77 岁(范围 70~90 岁),49% 为女性,24% 为 ECOG 0 分,64% 为 ECOG 1 分,12% 为 ECOG 2 分。大多数患者因认知(46%)、年龄(36%)或合并症(31.4%)被评估为衰弱。两组的中位 OS 没有显著差异,A 组和 B 组的中位 OS 分别为 4.7 个月和 4.4 个月(P = 0.72)。PFS、RR 以及影响早期治疗中止和低于预期生存率的因素将在今年 ASCO 年会上报告。数据截止时,A 组和 B 组 ≥ 3 级毒性反应发生率分别为 45.6% 和 58.7%(P = 0.10),≥ 4 级毒性反应发生率分别为 7.6% 和 14.7%(P = 0.16),两组最常见的 ≥ 3 级毒性反应包括贫血、中性粒细胞减少、两组的疲劳和 B 组的腹泻。
研究结论
EA2186 研究未能证明两种强度较小的化疗方案在 mPDAC 老年衰弱患者疗效或总体毒性方面存在显著差异。
Abstract 4005
标题:NRG Oncology/RTOG 0848: Results after adjuvant chemotherapy +/- chemoradiation for patients with resected periampullary pancreatic adenocarcinoma (PA)
NRG Oncology/RTOG 0848 研究:壶腹周围癌(PA)患者术后辅助化疗 ± 放化疗的结局
讲者:美国拉什大学医学中心 Karyn Goodman
研究背景
5-FU/卡培他滨增敏放疗是否有利于 PA 的辅助治疗疗效尚存在一定争议。NRG/RTOG 0848 研究旨在解决上述问题。
研究方法
这是一项美国国家临床试验网络(NCTN)随机(rndmzd)试验,分为两个阶段。第一阶段:患者随机接受 5 个周期的吉西他滨(gem)± 厄洛替尼治疗。第二阶段:患者随机接受第 6 个周期相同的化疗方案 ± 5-FU/卡培他滨放疗(50.4Gy/28f),即化疗 ± 同步放化疗(RCT)。
第一阶段的纳入标准为:接受过 R0/R1 切除术、M0、ECOG PS 0-1、CA19-9 ≤ 180 μ/mL。第二阶段的纳入标准为:接受过 > 4 个周期的化疗(gem、gem 联合治疗、改良 FOLFIRINOX)。放疗的纳入条件包括使用实时 3D/IMRT 治疗(RX)制定审查计划、评分和允许使用。
在第二阶段中,入组患者按淋巴结状态(+ vs. -),CA19-9 (≤ 90 vs. >90~180)、手术切缘(R0 vs. R1)和辅助化疗方案分层。主要研究终点是 OS,次要研究终点是无病生存期(DFS)和不良事件(AEs)。
假设化疗组的中位 OS 是 17 个月,化疗 + 同步放化疗组的中位 OS 是 22.5 个月,样本量需达到 354 例(HR = 0.76, 80%的效能,单侧 α = 0.05,316 个 OS 事件)。由于事件发生率低于预期,试验预设终点被修改为:(a)观察到 316 个 OS 事件,或(b)从第二阶段结束后开始的 5 年随访时间(265 个 OS 事件,72% 效能,相同 α)。OS 和 DFS 采用 Kaplan-Meier 估计,组间采用 log-rank 检验比较。多因素分析(MVA)采用 Cox 比例风险模型。
研究结果
该研究于 2009 年 11 月启动,于 2018 年 10 月停止招募。研究共纳入 354 例患者(化疗组 174 例,化疗 + 同步放化疗组 180 例)。所有患者和存活患者的中位随访分别为 2 年和 7 年,达到 270 个 OS 事件。患者中位年龄 63 岁,45% 为女性,81% 为白人,13%为 AA。83% 为 R0 切除,26% 为淋巴结阴性,96% 为 CA19-9 < 90 μ/mL。化疗 + 同步放化疗组有 13% 的患者未接受放疗。
AE 具有可比性:4 级 AE 方面,化疗组和化疗 + 同步放化疗组分别为 10% vs. 11%;两组各有 1 例 5 级 AE。单因素分析的 OS/DFS 结果见表 1。
表 1.与 DFS/OS 相关的单因素分析
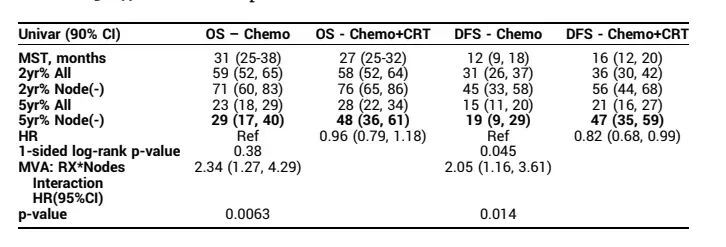
在初始多因素分析中,影像学评估(RX)、CA19-9、手术切缘与 OS 或 DFS 无显著相关性,但淋巴结状态与 OS、DFS 有显著相关性,种族与 OS 有显著相关性。在进一步的分析中,OS 和 DFS 均与 RX、淋巴结状态有显著的相关性。
淋巴结阴性患者采用化疗 + 同步放化疗治疗效果优于化疗。淋巴结阳性患者采用化疗 + 同步放化疗 vs. 化疗的疗效无显著差别。
研究结论
NRG Oncology/RTOG 0848 研究显示化疗 + 同步放化疗总体上没有改善 OS,但改善了 DFS。化疗 + 同步放化疗对淋巴结阴性患者的 OS 和 DFS 均有改善。与化疗相比,化疗 + 未同步放化疗未增加 Gr 4 或 5 AE。
Abstract 4015
标题:Development and validation of AI-assisted transcriptomic signatures to personalize adjuvant chemotherapy in patients with resectable pancreatic ductal adenocarcinoma
开发和验证人工智能辅助转录组特征,用于指导可切除胰腺导管腺癌(PDAC)患者的个体化辅助化疗
讲者:法国马赛癌症研究中心 Nelson Dusetti
研究背景
针对胰腺导管腺癌(PDAC)患者的辅助化疗方案,体能强健的患者可使用改良 FOLFIRINOX(mFFX)或基于吉西他滨的方案,其他患者可使用吉西他滨或 5-FU 单药。mFFX 虽然更有效,但与其他相比方案,其毒性更大。此外,治疗决策仍然主要依赖于患者的体能评分(PS)状态,而非仅仅基于肿瘤本身特征。本研究旨在开发并应用针对常见胰腺癌药物的转录组学特征来指导个体化治疗。
研究方法
本研究分析了三种临床前模型(免疫缺陷小鼠原代细胞培养、类肿瘤和患者来源的异种移植物)对药物(5-氟尿嘧啶、奥沙利铂和伊立替康)的反应。随后,研究者将检测到的药物敏感性与每个模型的转录组学数据联系起来。本研究还纳入了先前开发的「吉西他滨特征(gemcitabine signature)」。最后,我们使用了一种机器学习方法,即「LASSO 回归与随机森林(Least Absolute Shrinkage and Selection Operator-random forest)」来改进特征,整合肿瘤微环境的主要调控因子。
学习队列分为针对吉西他滨的GemPred(队列1)和针对 mFFX 的 COMPASS(队列 2)。由此产生的转录组预测工具被称为胰腺视图(Pancreas-View)。研究者在由 343 名患者组成的 PRODIGE-24/CCTG PA6 试验队列(队列 3)中验证了上述特征。
研究结果
结果显示,上述特征或可识别出对特定药物有反应的患者,且这些患者接受相应的治疗策略(mFFX 或吉西他滨)时,其癌症特异性生存(CSS)和无病生存期(DFS)显著改善。此外,研究者还发现,肿瘤预测敏感的药物数量与接受「适配」方案的患者生存之间存在正相关。接受「适配」药物治疗的患者(n = 164;47.8%)的 DFS 更长,其中,mFFX 组的中位 DFS 为 50.1 个月(分层 HR:0.31;95% CI,0.21-0.44;P<0.001),吉西他滨组的中位 DFS 为 33.7 个月(分层 HR:0.40;95% CI,0.17-0.59;P<0.001)。相反,接受与特征预测不匹配的治疗的患者(n = 86;25.1%)和预测对所有药物有耐药性的患者(n = 93;27.1%)的 DFS 结果最差(分别为 10.6 个月和 10.8 个月)。
研究结论
该研究通过整合临床前模型和机器学习,开发了一种基于转录组的综合预测工具,可能有助于识别肿瘤对 mFFX 和吉西他滨的敏感性。至关重要的是,这些转录组特征还可以避免不必要的给药从而降低毒性。
Abstract 4016
标题:Tumor microbiome differences in early-onset versus average-onset pancreatic adenocarcinoma
早发性胰腺癌与平均发病胰腺癌的肿瘤微生物组差异
讲者:美国陶西格癌症中心 Thejus Jayakrishnan
研究背景
包括胰腺导管腺癌(PDAC)在内的早发性胃肠道癌症发病风险逐渐增加,但其潜在的发病机制尚不清楚。肿瘤微生物组对肿瘤发病机制和预后有所影响,因而成为当前研究的热点问题。
研究方法
研究者评估了早发性 PDAC(eoPDAC)和平均发病性 PDAC(aoPDAC)切除标本的微生物组谱。研究者从克利夫兰诊所和罗斯威尔公园癌症研究所生物库中连续选择 PDAC 标本,并根据诊断年龄(< 50 岁定义为 eoPDAC, > 50 岁定义为 aoPDAC)进行分类;使用鸟枪法宏基因组测序(shotgun metagenomic sequencing)对组织的微生物组进行记录。Alpha 多样性表示特定样品中微生物物种的丰富度和均匀性,研究者使用 Wilcoxon 秩和检验进行比较;利用置换方差分析对代表微生物分类学差异的 β 多样性进行差异检验,所有的 P 值都进行了多重检验调整。
研究结果
该研究纳入 44 例切除的 PDAC 患者(24 例 eoPDAC 和 20 例 aoPDAC)。质量检查后,研究者选择了 63 个组织标本进行分析(eoPDAC 为肿瘤标本 13 个,邻近正常标本 10 个;aoPDAC 为肿瘤标本和邻近正常标本各 20 个)。与邻近的正常组织相比(P = 0.02),eoPDAC 的肿瘤标本表现出更高的 α 多样性(P = 0.0062),aoPDAC 则没有(肿瘤vs. 正常组织的 α 多样性:P = 0.31)。β 多样性分析显示,各组间多样性差异显著(P < 0.05)。
在 eoPDAC 标本与 aoPDAC 标本(259/302;85.8%)、eo PDAC 标本与正常组织标本(262/366;71.6%)的比较中,大多数微生物种群未见重叠。差异丰度分析显示,eoPDAC 与 aoPDAC 的肿瘤微生物组差异显著(P < 0.05)。表 2 中列出了 PDAC 肿瘤标本中常见的细菌属。
表 2.eoPDAC 和 aoPDAC 常见的细菌属
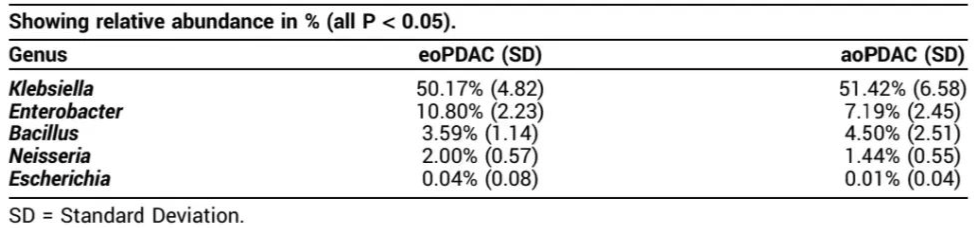
EoPDAC 肿瘤组织富集肠杆菌属、奈瑟氏菌属和埃希氏菌属,aoPDAC 肿瘤组织富集克雷伯氏菌属和芽孢杆菌属。
研究结论
该研究显示,与 aoPDAC 相比,eoPDAC 具有不同的微生物组特征。研究者认为,本研究识别出的胰腺疾病相关微生物种群至关重要,值得进一步探索。这一结论或可解释 eoPDAC 发病率的不断上升,并助力开发基于微生物组的生物标志物用于 eoPDAC 的筛查和治疗。





發表評論 取消回复