作为全球慢性肾脏病的重要病因之一,肾小球疾病发病率较高,因此有效的疾病诊断和优化管理对于控制病情、阻止肾病进展尤为重要 [1]。长期以来,肾小球疾病的临床管理都备受关注,以期新的诊疗给患者带来更多的获益。
在本次 WCN 年会上,来自阿根廷、法国和英国的多位肾病学专家就 IgA 肾病、膜性肾病和膜增生性肾小球肾炎等肾小球疾病的临床管理为话题展开讨论,进行了精彩报告。
✦ +
+
一、IgA 肾病的管理更新
Hernán Trimarchi 教授
01
基因表达在 IgA 肾病发生发展中的作用
Trimarchi 教授从人类进化史开篇,讲述了慢性肾病的发病因素,指出生活环境和个体适应对于慢性肾病的发生发展存在影响。
与 HLA 系统、半乳糖转移酶、免疫补体系统及表观遗传学有关的基因均与 IgA 肾病的发病机制相关 [2],提示某些等位基因或基因变异可能会影响 IgA 肾病的治疗效果,因此可作为指导治疗的生物标记物。
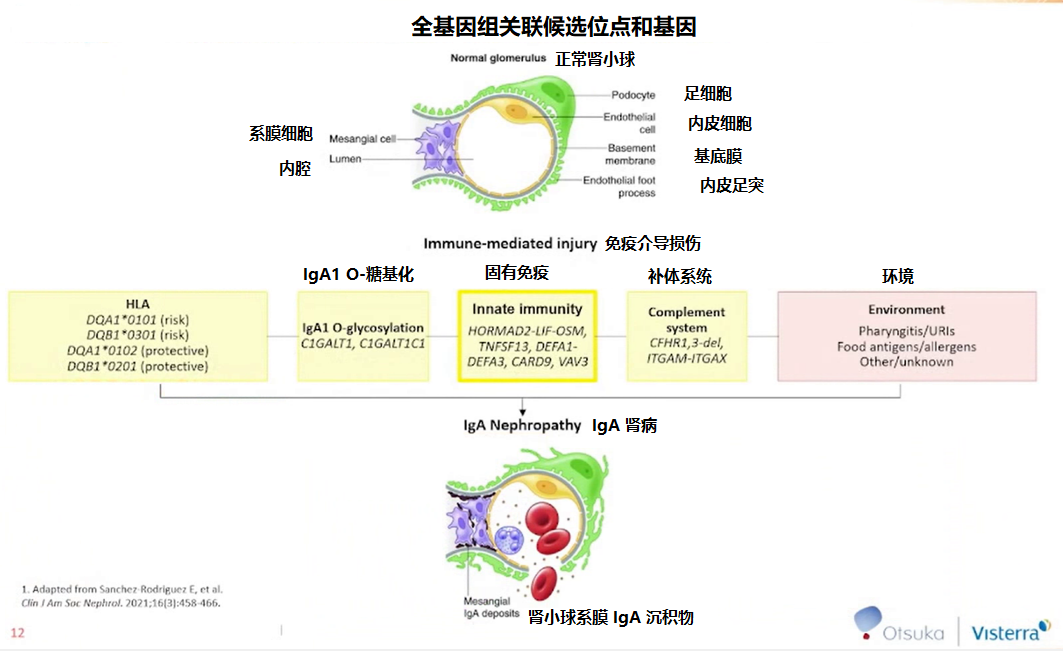
图 1 IgA 肾病相关的候选位点和基因
(图片来源:讲者 PPT)
02
早期干预有助于减少蛋白尿和肾纤维化
然后,Trimarchi 教授指出,蛋白尿在慢性肾病 1 期已经出现,可作为慢性肾病的早期生物标记物 [3]。
英国一项研究发现 [4],30% 的慢性肾病患者存在蛋白尿,且 10 年间存在高的平均尿蛋白量会显著增加终末期肾病的发生机率。他提出尽早开始对于蛋白尿的治疗干预。
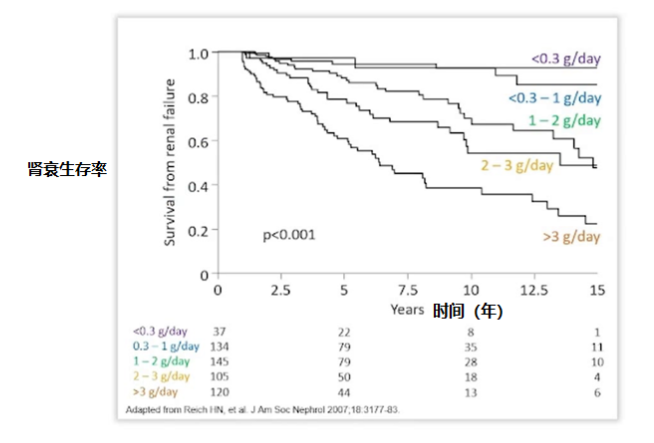
图 2 尿蛋白量与肾衰患者生存率的关系
(图片来源:讲者 PPT)
Trimarchi 教授建议早期使用肾素血管紧张素系统抑制剂 (RASi)、SGLT2 抑制剂、内皮受体拮抗剂、盐皮质激素受体拮抗剂等药物来减少蛋白尿和肾纤维化[5-8]。
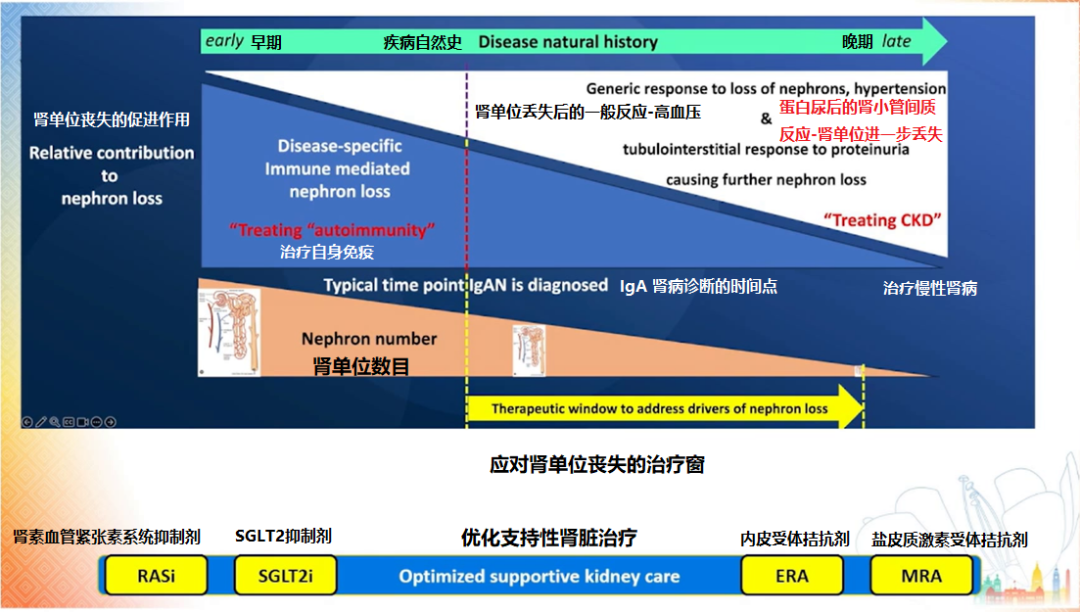
图 3 IgA 肾病发展过程及治疗时机
(图片来源:讲者PPT)
03
关注炎症、纤维化和致病性 IgA 合成相关研究
本报告还讨论了关于肾损伤的研究进展。Trimarchi 教授提出需要重点关注炎症、纤维化和致病性 IgA 合成对于 IgA 介导的肾损伤发展的影响,以及针对这些机制的治疗选择,如使用类固醇 [9]、补体抑制剂 [10] 及 B 细胞耗竭疗法 [11]。
值得注意的是,有研究发现耐赋康(nefecon,布地奈德迟释胶囊)具有潜在益处,能够延缓 IgA 肾损伤患者的肾功能丢失 [12]。
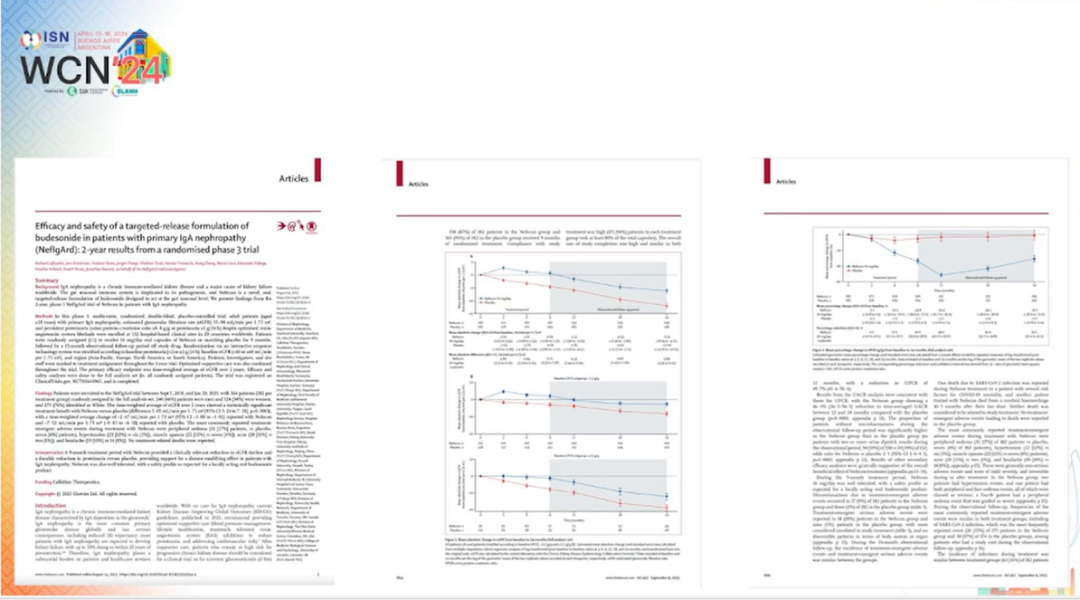
图 4 耐赋康治疗 IgA 肾病的 3 期临床试验
(图片来源:讲者 PPT)
04
需要加强发展中国家的临床试验,提高药物可及性
最后,Trimarchi 教授指出了临床试验存在明显的地域差异。其中,在北美及欧洲开展的相关临床试验远多于亚洲、南美及南非地区。他呼吁并强调建立低收入国家患者获得药物的公平渠道,提高 IgA 肾病治疗药物在全球范围的可及性。

图 5 全球临床试验情况
(图片来源:讲者 PPT)
✦ +
+
二、膜性肾病的分类及管理
Pierre Ronco 教授
01
膜性肾病抗原发现和免疫测试的意义
PLA2R 等抗原的发现导致了膜性肾病的诊断和监测模式发生转变。而酶联免疫吸附试验 (ELISA) 和免疫荧光测试结果有助于预测临床结局。
Ronco 教授还提到,ELISA 可帮助确定肾活检的适应证。对于 ELISA 阳性患者,如果没有极端表现或肾功能恶化,并不一定需要进行肾活检。相反,ELISA 阴性的患者则应进行肾活检 [13]。
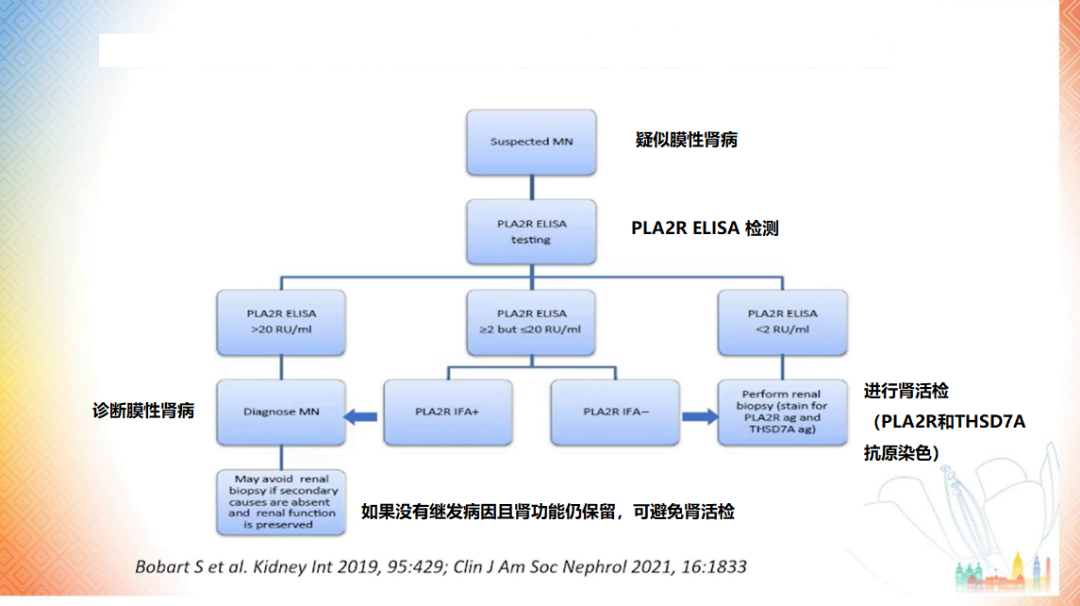
图 6 使用 PLA2R 抗体进行膜性肾病的非侵入性诊断思路
(图片来源:讲者 PPT)
02
膜性肾病新抗原可帮助预测临床结局
Exosite 1 和 2 被认为是与(伴或不伴增殖性病变)的 V 型狼疮性肾炎相关的新抗原,可在循环血中检测到 [14],他们的存在预示着好的临床结局 [15-16]。
同样,活检呈现 Exosite 染色阳性的膜性肾病患者相较于染色阴性患者具有更高的生存率 [15]。Exosite 阳性的膜性肾病患者多为女性,常有自身免疫的表现,将来有可能发展为狼疮性肾炎。患者体内还可检测出 C1q 和 IgG 4 亚组蛋白 [14]。
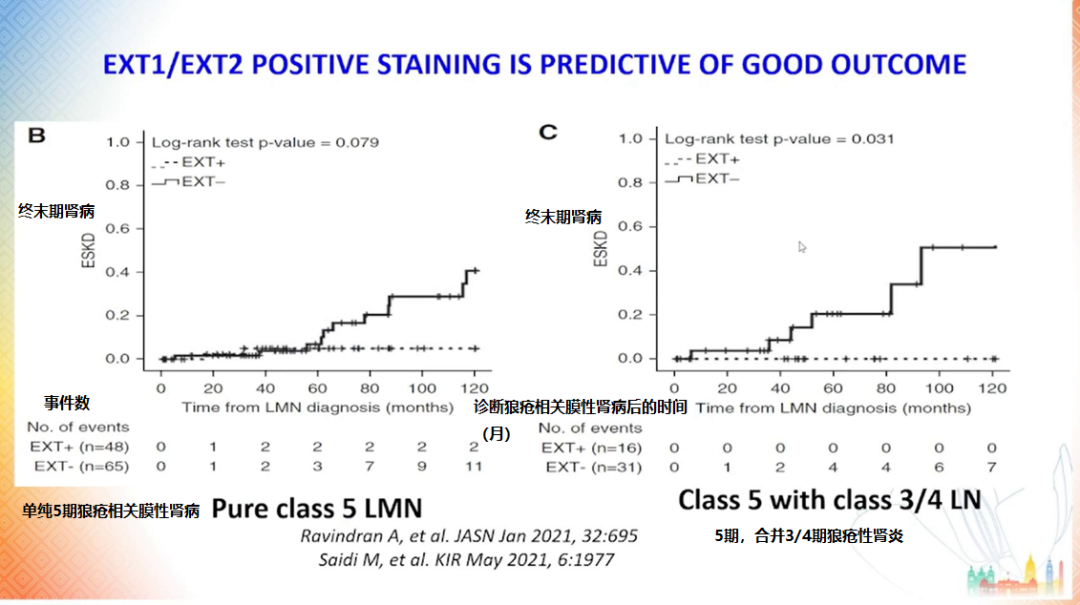
图 7 Exosite 染色阳性对于良好结局的预测作用
(图片来源:讲者PPT)
而另一新抗原,神经表皮生长因子 1(NELL-1)也可用于预测膜性肾病的结局,同时定义了膜性肾病的新类型,即 NELL-1 相关膜性肾病 [17]。合并恶性肿瘤的膜性肾病患者血清中也可检测出 NELL-1 抗体及 NELL-1 抗原 [18]。而在肾病综合征发作前使用传统医学治疗会增加 NELL-1 抗原的测出率 [19]。
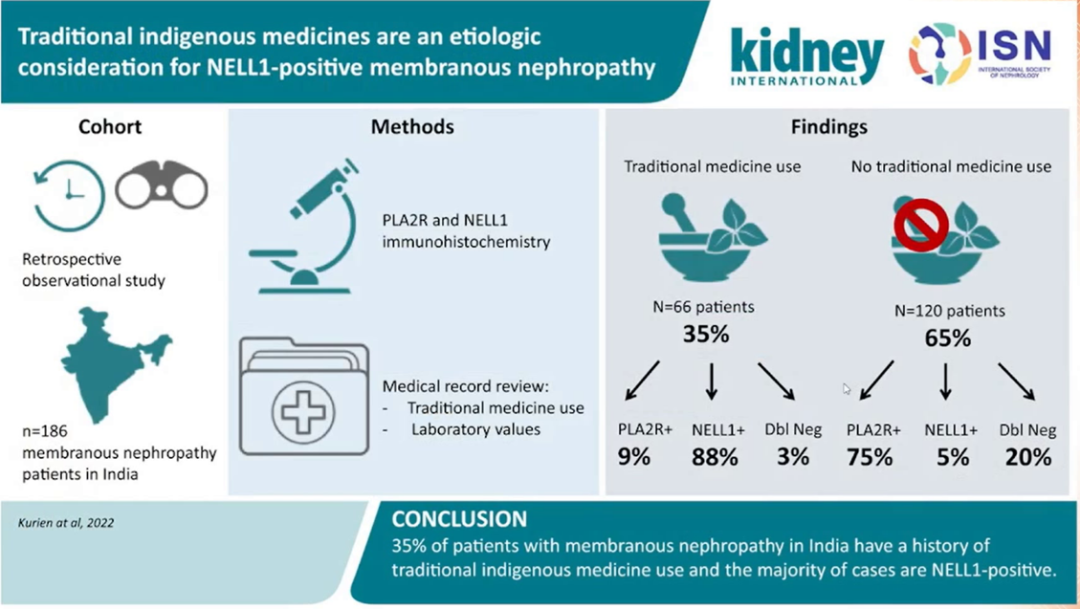
图 8 使用传统医药与 NELL-1 阳性膜性肾病的相关性
(图片来源:讲者 PPT)
03
膜性肾病诊断的两步分类法
Ronco 教授提出基于抗原的膜性肾病分类方法 [20],这将有助于临床医生将抗原与特定的临床表现及病因进行结合,从而辅助诊断和治疗。在此基础上,他还提出了相关术语的新命名法,以明确病因、提示治疗方向。具体方法包括在抗原名字前添加「 膜性肾病相关 」的前缀,如 「 膜性肾病相关 NELL-1」,以及列出相关情况,如 「 硫辛酸 」 等。
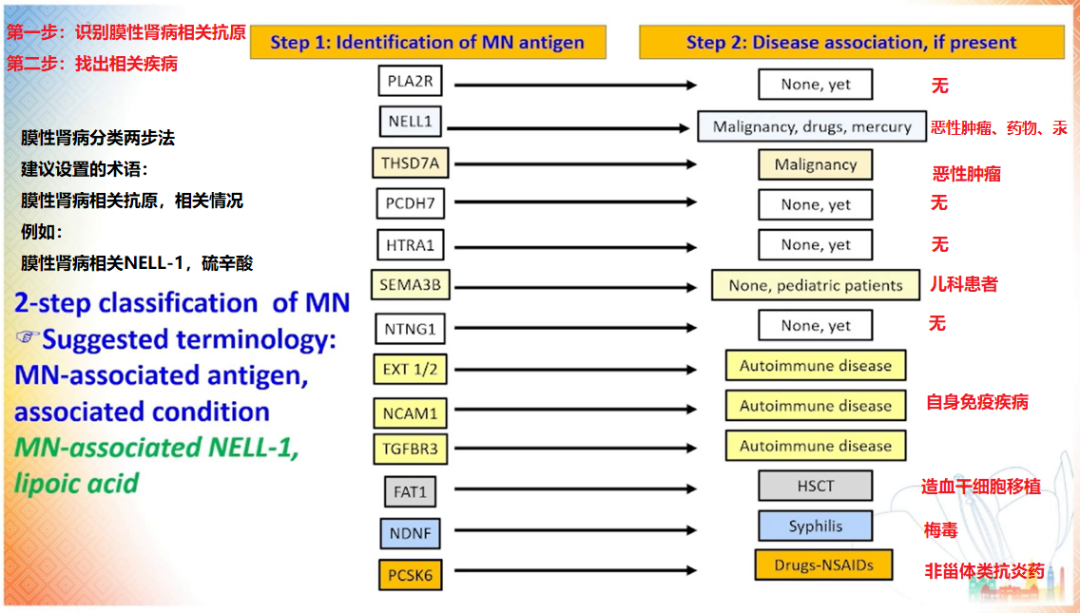
图 9 膜性肾病分类两步法
(图片来源:讲者 PPT)
最后,他讨论了个体化的膜性肾病的诊断和治疗仍面临较多的的挑战,未来仍需要更多研究和临床实践不断探索和总结经验,以优化患者的治疗。
✦ +
+
三、膜增生性肾小球肾炎的管理更新
Sanjeev Sethi 教授
01
膜增生性肾小球疾病的特点和具体分型
传统的膜增生性肾小球肾炎 (MPGN) 分类方法主要是基于电镜下电子致密物沉积部位。根据病因,MPGN 可以分为原发性(特发性)和继发性(丙肝感染等)。而根据电子显微镜下沉积物的特点,原发性 MPGN 可分为 I 型、II 型、III 型。

图 10 传统的 MPGN 分型
(图片来源:依据讲者 PPT 整理)
但 Sethi 教授发现,不同的 MPGN 患者常可找到对应的病因。因此他与团队提出了一个新的简单分类方法,即基于活检和免疫荧光检测的发现,将 MPGN 分为免疫复合物介导的肾小球肾炎或 C3(补体介导的)肾小球肾炎 [21]。
他认为这个分类方法能够更可靠地识别真实病因,同时强调进行分类时,确定病因十分重要。需要考虑的潜在病因可包括免疫复合物介导、补体介导、单克隆免疫球蛋白病和自身免疫病等。
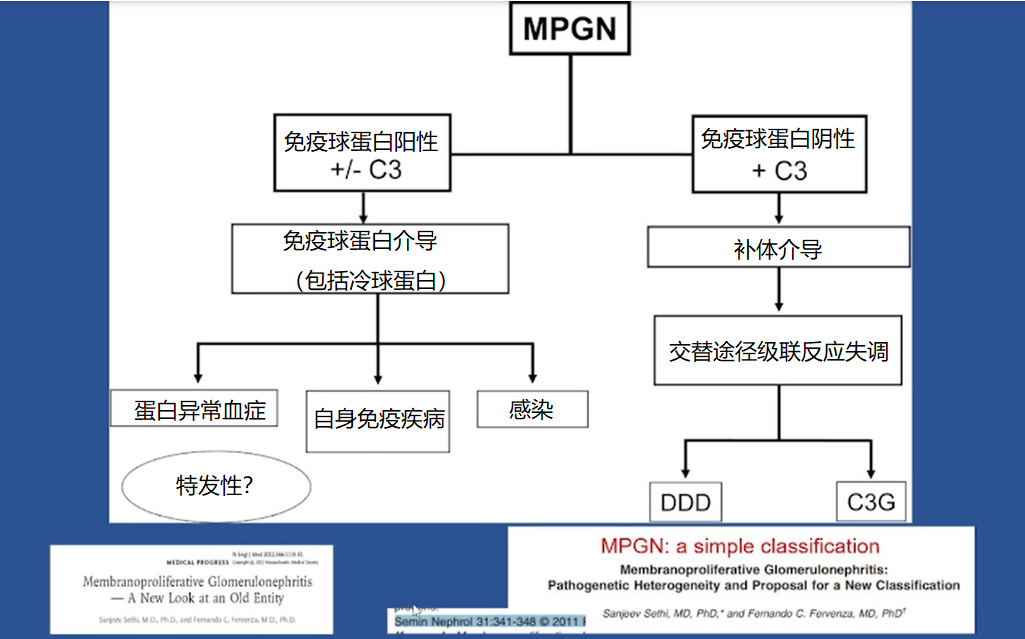
图 11 不同类型 MPGN 的相关病因
DDD: 致密沉积病;C3G: C3 肾小球肾炎
(图片来源:讲者 PPT)
02
通过载脂蛋白 E 来区分 C3 肾小球肾炎和致密物沉积病
Sethi 教授还强调,载脂蛋白 E 是致密物沉积病(DDD)的重要成分,可作为染色标记,用于 C3 肾小球肾炎和致密沉积病的鉴别诊断 [22]。电子显微镜和载脂蛋白 E 染色是区分这两种疾病的重要工具。
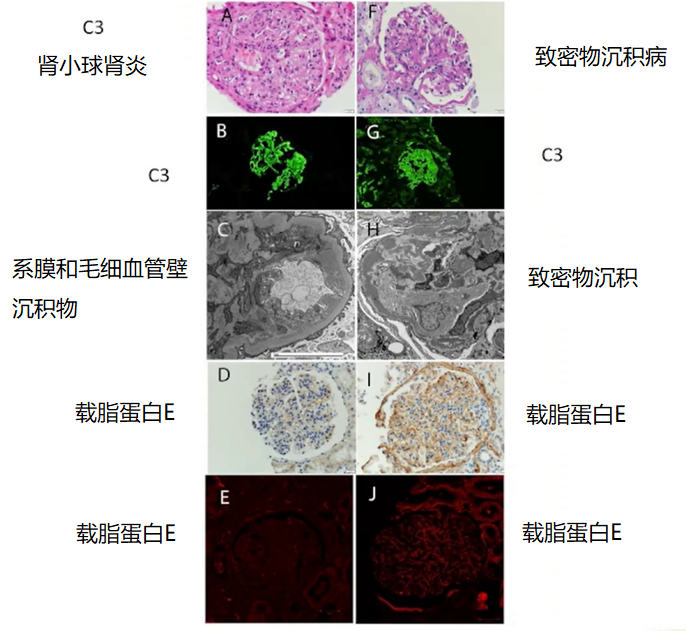
图 12 C3 肾小球肾炎与致密物沉积病不同的镜下表现
(图片来源:讲者 PPT)
✦ +
+
四、专家解读会议要点
东南大学附属中大医院 王凤梅教授

近年来,随着科技的发展和研究方法的创新,肾小球疾病的诊断、治疗和管理得得到快速的发展,其中也包含临床常见的 IgA 肾病和膜性肾病,以及不常见的 MPGN。
随着对 IgA 肾病发病机制的深入研究,目前在致病机制的任何一个环节基本上都有新药物研发和验证,同时结合国际多中心的 RCT 研究的一些重要结果,IgA 肾病患者需要更加个体化的诊疗,比如新型药物使用 nefecon 等,以及参加临床药物验证,但是国际上临床药物验证的资源存在地区差异。Trimarchi 教授在本次会议上也呼吁需要加强发展中国家的临床试验,提高药物可及性。
目前随着对膜性肾病的深入研究,认识到了越来越多不同抗原相关的膜性肾病,不同类型的膜性肾病的临床及病理特点、结局及合并症截然不同。Pierre Ronco 教授指出,对于膜性肾病的个体化诊疗仍任重而道远。
MPGN 不是一个病,而是不同病因所致的一种肾脏损伤的组织病理学形式,需要去找到潜在的损伤病因。本次会议上 Sethi 教授强调基于活检和免疫荧光检测的发现,将 MPGN 分为免疫复合物介导的肾小球肾炎或 C3(补体介导的)肾小球肾炎。同时还进一步强调通过载脂蛋白 E 来区分 C3 肾小球肾炎和致密物沉积病,使得人们对 MPGN 的认识又加深了一步,同时补体系统均参与了以上两种疾病的发生发展。
本文首发于丁香园旗下专业平台:丁香园肾内时间
整理 | 梁文婕
审核 | 王凤梅教授
投稿 | huangwendi@dxy.cn
配图 | 讲者 PPT 或根据讲者 PPT 制作
题图 | 站酷海洛
参考文献(上下滑动查看)
[1] Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021;100(4S):S1-S276. doi:10.1016/j.kint.2021.05.021
[2] Sanchez-Rodriguez E, Southard CT, Kiryluk K. GWAS-Based Discoveries in IgA Nephropathy, Membranous Nephropathy, and Steroid-Sensitive Nephrotic Syndrome. Clin J Am Soc Nephrol. 2021;16(3):458-466. doi:10.2215/CJN.14031119
[3] Trimarchi H, Canzonieri R, Schiel A, et al. Podocyturia is significantly elevated in untreated vs treated Fabry adult patients [published correction appears in J Nephrol. 2016 Jun;29(3):459-460]. J Nephrol. 2016;29(6):791-797. doi:10.1007/s40620-016-0271-z.
[4] Reich HN, Troyanov S, Scholey JW, Cattran DC; Toronto Glomerulonephritis Registry. Remission of proteinuria improves prognosis in IgA nephropathy. J Am Soc Nephrol. 2007;18(12):3177-3183. doi:10.1681/ASN.2007050526
[5] Wheeler DC, Toto RD, Stefánsson BV, et al. A pre-specified analysis of the DAPA-CKD trial demonstrates the effects of dapagliflozin on major adverse kidney events in patients with IgA nephropathy. Kidney Int. 2021;100(1):215-224. doi:10.1016/j.kint.2021.03.033.
[6] The EMPA-KIDNEY Collaborative Group, Herrington WG, Staplin N, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2023;388(2):117-127. doi:10.1056/NEJMoa2204237.Heerspink HJL, Radhakrishnan J, Alpers CE, et al. Sparsentan in patients with IgA nephropathy: a prespecified interim analysis from a randomised, double-blind, active-controlled clinical trial. Lancet. 2023;401(10388):1584-1594. doi:10.1016/S0140-6736(23)00569-X.
[8] Rovin BH, Barratt J, Heerspink HJL, et al. Efficacy and safety of sparsentan versus irbesartan in patients with IgA nephropathy (PROTECT): 2-year results from a randomised, active-controlled, phase 3 trial. Lancet. 2023;402(10417):2077-2090. doi:10.1016/S0140-6736(23)02302-4.
[9] Lv J, Wong MG, Hladunewich MA, et al. Effect of Oral Methylprednisolone on Decline in Kidney Function or Kidney Failure in Patients With IgA Nephropathy: The TESTING Randomized Clinical Trial. JAMA. 2022;327(19):1888-1898. doi:10.1001/jama.2022.5368.
[10] Zhang H, Rizk DV, Perkovic V, et al. Results of a randomized double-blind placebo-controlled Phase 2 study propose iptacopan as an alternative complement pathway inhibitor for IgA nephropathy. Kidney Int. 2024;105(1):189-199. doi:10.1016/j.kint.2023.09.027.
[11] Mathur M, Barratt J, Chacko B, et al. A Phase 2 Trial of Sibeprenlimab in Patients with IgA Nephropathy. N Engl J Med. 2024;390(1):20-31. doi:10.1056/NEJMoa2305635.
[12] Lafayette R, Kristensen J, Stone A, et al. Efficacy and safety of a targeted-release formulation of budesonide in patients with primary IgA nephropathy (NefIgArd): 2-year results from a randomised phase 3 trial [published correction appears in Lancet. 2023 Sep 9;402(10405):850]. Lancet. 2023;402(10405):859-870. doi:10.1016/S0140-6736(23)01554-4.
[13] Bobart SA, Han H, Tehranian S, et al. Noninvasive Diagnosis of PLA2R-Associated Membranous Nephropathy: A Validation Study. Clin J Am Soc Nephrol. 2021;16(12):1833-1839. doi:10.2215/CJN.05480421.
[14] Sethi S, Madden BJ, Debiec H, et al. Exostosin 1/Exostosin 2-Associated Membranous Nephropathy. J Am Soc Nephrol. 2019;30(6):1123-1136. doi:10.1681/ASN.2018080852.
[15] avindran A, Casal Moura M, Fervenza FC, et al. In Patients with Membranous Lupus Nephritis, Exostosin-Positivity and Exostosin-Negativity Represent Two Different Phenotypes. J Am Soc Nephrol. 2021;32(3):695-706. doi:10.1681/ASN.2020081181.
[16] Saïdi M, Brochériou I, Estève E, et al. The Exostosin Immunohistochemical Status Differentiates Lupus Membranous Nephropathy Subsets With Different Outcomes. Kidney Int Rep. 2021;6(7):1977-1980. Published 2021 May 5. doi:10.1016/j.ekir.2021.04.025.
[17] Sethi S, Debiec H, Madden B, et al. Neural epidermal growth factor-like 1 protein (NELL-1) associated membranous nephropathy. Kidney Int. 2020;97(1):163-174. doi:10.1016/j.kint.2019.09.014.
[18] Caza TN, Hassen SI, Dvanajscak Z, et al. NELL1 is a target antigen in malignancy-associated membranous nephropathy. Kidney Int. 2021;99(4):967-976. doi:10.1016/j.kint.2020.07.039.
[19] Kurien AA, Prema Ks J, Walker PD, Caza TN. Traditional indigenous medicines are an etiologic consideration for NELL1-positive membranous nephropathy. Kidney Int. 2022;102(6):1424-1426. doi:10.1016/j.kint.2022.09.001.
[20] Sethi S, Beck LH Jr, Glassock RJ, et al. Mayo Clinic consensus report on membranous nephropathy: proposal for a novel classification. Kidney Int. 2023;104(6):1092-1102. doi:10.1016/j.kint.2023.06.032.
[21] Sethi S, Fervenza FC. Membranoproliferative glomerulonephritis--a new look at an old entity. N Engl J Med. 2012;366(12):1119-1131. doi:10.1056/NEJMra1108178.
[22] Madden B, Singh RD, Haas M, et al. Apolipoprotein E is enriched in dense deposits and is a marker for dense deposit disease in C3 glomerulopathy. Kidney Int. 2024;105(5):1077-1087. doi:10.1016/j.kint.2024.02.013.





發表評論 取消回复