近年来,胰高血糖素样肽-1 受体激动剂(GLP-1RA)以其良好的降糖、减重等综合代谢改善作用和显著的心肾获益,被多部糖尿病与心血管疾病权威指南推荐作为 2 型糖尿病(T2DM)合并动脉粥样硬化性心血管疾病(ASCVD)或高风险患者的一线治疗选择[1-4]。临床中部分患者用药初期可能出现一定程度的不良反应,其中最常见的是胃肠道反应[5]。
司美格鲁肽是目前临床常用的 GLP-1RA,有注射液和片剂两种剂型。司美格鲁肽片是全球首个且目前唯一获批的口服 GLP-1RA,作为经消化道吸收的肽类药物,这项创新技术是否会带来额外的胃肠道事件风险?那么,基于现有循证证据,我们对司美格鲁肽片的胃肠道反应相关问题进行答疑解惑,以供临床参考。
一问:
司美格鲁肽片如何经消化道吸收?
司美格鲁肽片主要是由活性药物成分司美格鲁肽和渗透促进剂 N-[8-(2-羟基苯甲酰基)-氨基]辛酸钠(SNAC)组成的复合制剂。该药物采用创新技术,利用 SNAC 提高胃内局部 pH 值,帮助司美格鲁肽抵抗胃蛋白酶的降解,同时促进司美格鲁肽单体化,最终实现司美格鲁肽在胃内跨细胞吸收(图 1)[6]。
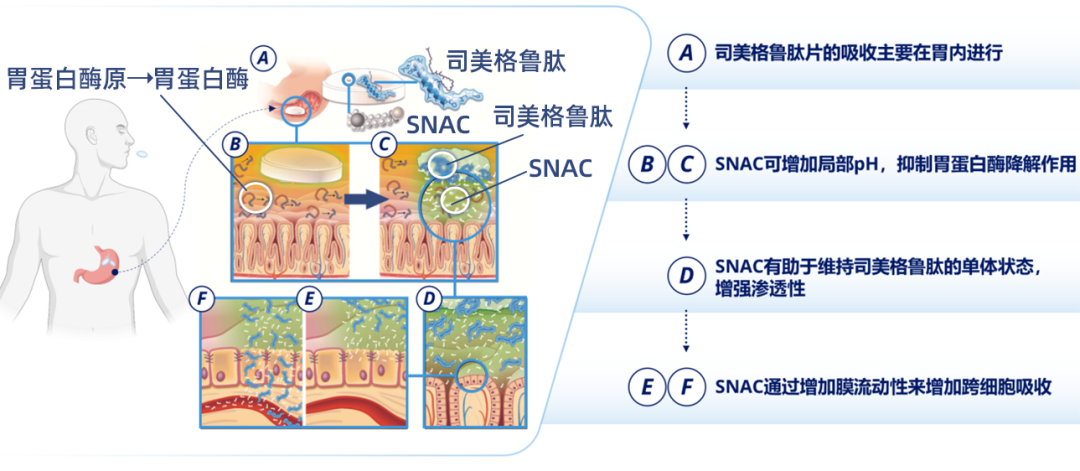
图 1. SNAC 促进司美格鲁肽吸收作用机制[6]
SNAC 的促吸收过程充分可逆。一项体外实验表明 SNAC 与胃黏膜作用一段时间后将 SNAC 去除,此后于不同时间点添加司美格鲁肽观察 SNAC 残留的促渗透作用,结果发现随着时间推移,SNAC 的促渗透作用逐渐减弱,30 min 后胃黏膜对司美格鲁肽的表观渗透系数已基本恢复至基线水平(图 2 左)。从组织学角度来看,胃黏膜短暂暴露于 SNAC 后的 30 min 及 120 min,胃黏膜上皮细胞显示完整(图 2 右)[6]。
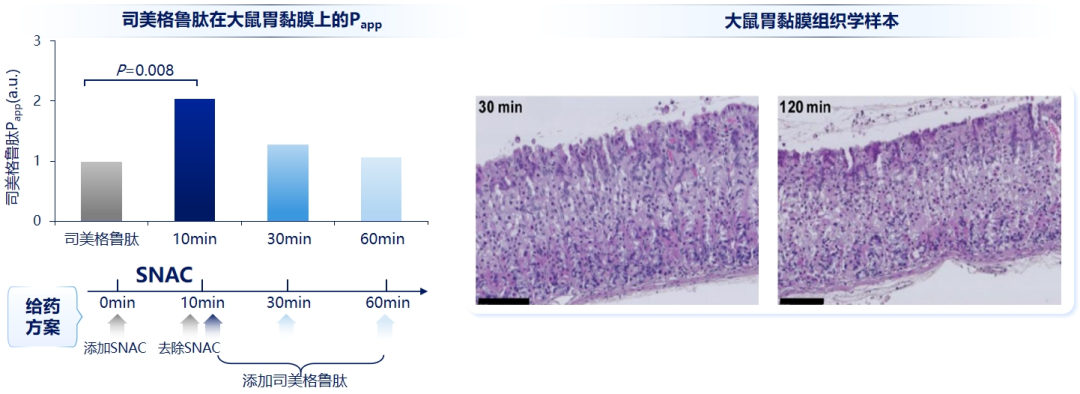
注:(图左)对大鼠胃黏膜细胞进行体外试验,一组仅添加司美格鲁肽,另一组添加 SNAC 后 10 min 去除,然后分别在 10/30/60 min 分别加入司美格鲁肽,测定其表观渗透系数(Papp),结果显示在第 10 min 时司美格鲁肽渗透率显著升高,但 30/60 min 后其 Papp 再次回归到无 SNAC 的水平;(图右)暴露于 SNAC 后 30 min 和 120 min 的组织学样本显示,胃黏膜上皮细胞完整
图 2. SNAC 促进司美格鲁肽吸收作用可逆[6]
二问:
司美格鲁肽片能否与胃肠道 GLP-1 受体发生作用?
在 SNAC 的作用下,司美格鲁肽片可以达到约 1% 的生物利用度[6]。那么未被吸收的司美格鲁肽何去何从呢?一项体外实验,观察了不同 pH 环境下胃蛋白酶对司美格鲁肽的作用,并根据司美格鲁肽剩余量以反映其在胃内的半衰期,发现当 pH 为 2.6 时,在胃蛋白酶的作用下,司美格鲁肽的估算半衰期仅为 16 min,提示未被吸收的司美格鲁肽在胃内即被大量降解,而肠道中更加丰富的消化酶会进一步充分降解司美格鲁肽[6]。因而,不会有大量完整司美格鲁肽分子进入肠道中与肠黏膜 GLP-1 受体发挥作用。
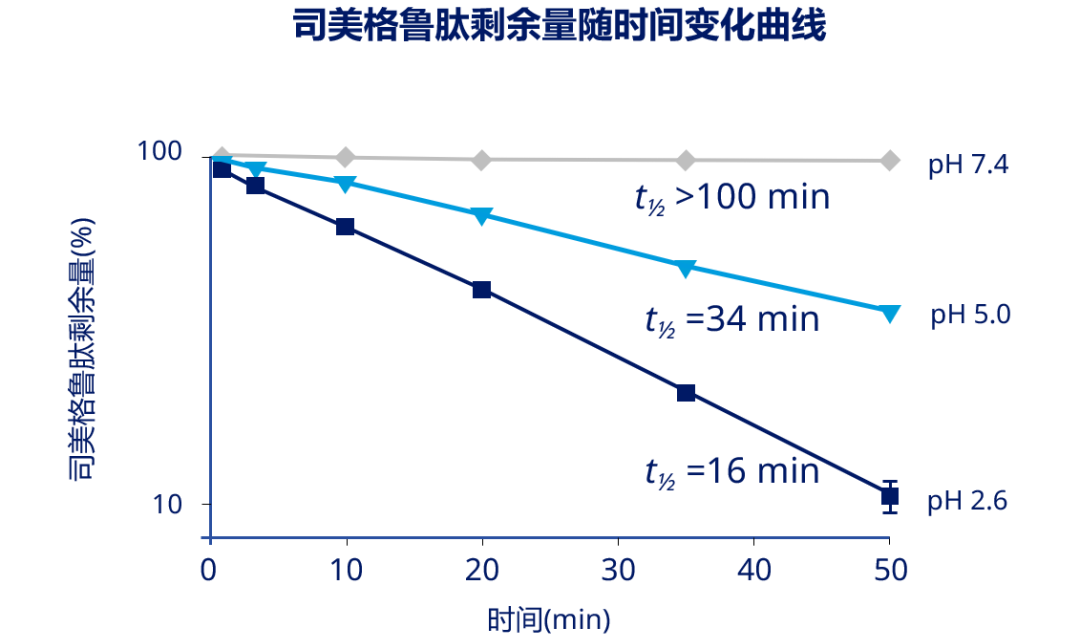
注:在不同 pH 环境下(pH = 2.6/5.0/7.4)将司美格鲁肽与胃蛋白酶共同孵育,测定剩余司美格鲁肽量,并估算其半衰期,在酸性环境下,司美格鲁肽快速降解,而随着 pH 升高,司美格鲁肽降解速度减缓,半衰期延长
图 3. 司美格鲁肽在酸性环境下被胃蛋白酶快速降解
那么,胃内的司美格鲁肽是否会与胃黏膜表面的 GLP-1 受体发挥作用呢?动物实验提示胃中 GLP-1 受体几乎均表达于 H+/K+-ATP 酶阳性的壁细胞中,壁细胞主要分布于胃小凹开口下方胃腺的颈、体部,即胃上皮顶部缺乏 GLP-1 受体分布(图 4 左、中),而司美格鲁肽的吸收主要发生在胃上皮顶部的区域(图 4 中),因此,从司美格鲁肽吸收时的空间分布来看,其对胃内 GLP-1 受体没有直接作用。尽管曾有研究发现 GLP-1 可能具有抑制胃酸分泌的功能,但在人体试验也未发现司美格鲁肽片对胃内 pH 基础状态的影响(图 4 右)[6]。提示司美格鲁肽片与胃黏膜 GLP-1 受体无明显相互作用。
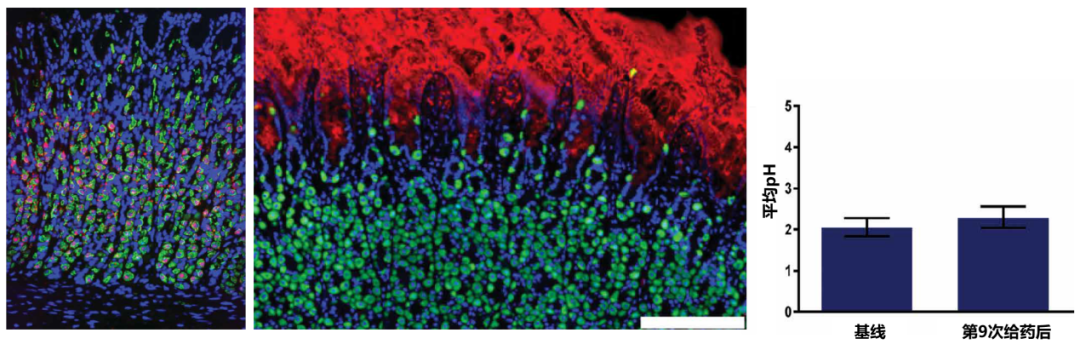
注:(图左)大鼠胃体黏膜 GLP-1 受体 mRNA(红色信号)几乎均表达于壁细胞(绿色信号,标记 ATP 酶)中;(图中)狗的胃黏膜中大部分壁细胞(绿色,标记 ATP 酶)位于胃小凹更深的位置,而司美格鲁肽(红色)主要作用于胃上皮顶部到颈部的区域;(图右)人服用司美格鲁肽片 10 mg/天,10 天后胃内平均 pH 较基线无明显变化
图 4. 胃内 GLP-1 受体表达于壁细胞,司美格鲁肽片主要在黏膜表面进行吸收,司美格鲁肽片不影响整体胃内平均 pH 值
三问:
司美格鲁肽片是否会增加胃肠道不良反应?
PIONEER 系列研究是司美格鲁肽片的 Ⅲ 期临床研究,在广泛的 T2DM 患者中验证了司美格鲁肽片的疗效及安全性,其中 PIONEER 11、12 是以中国人群为主(中国人群约占 75%)的研究,验证了中国人群 T2DM 患者中司美格鲁肽片作为单药起始(PIONEER 11 安慰剂对照)[7]或联合二甲双胍治疗(PIONEER 12 西格列汀活性对照)[8]的疗效及安全性。
与其他 GLP-1RA 相似,胃肠道不良反应也是司美格鲁肽片主要的不良反应,其中恶心、腹泻最为常见,多呈轻中度,且多发生于药物的剂量递增阶段,持续时间相对较短,患者多可耐受[7,8]。总体而言,司美格鲁肽片在中国人群的胃肠道不良反应发生率与国际数据一致(图 5 上)[7,9],与司美格鲁肽注射液在 SUSTAIN 系列研究中的中外数据亦相似(图 5 下)[9,10]。因此,从临床研究数据间接对比来看,相较于注射剂型而言,司美格鲁肽片并未增加胃肠道不良反应发生率。在纳入了 9 项 PIONEER 研究的汇总数据分析中,因胃肠道不良事件导致提前停用司美格鲁肽片的发生率仅占 5.9%(4,116 例受试者暴露于司美格鲁肽片)[9]。
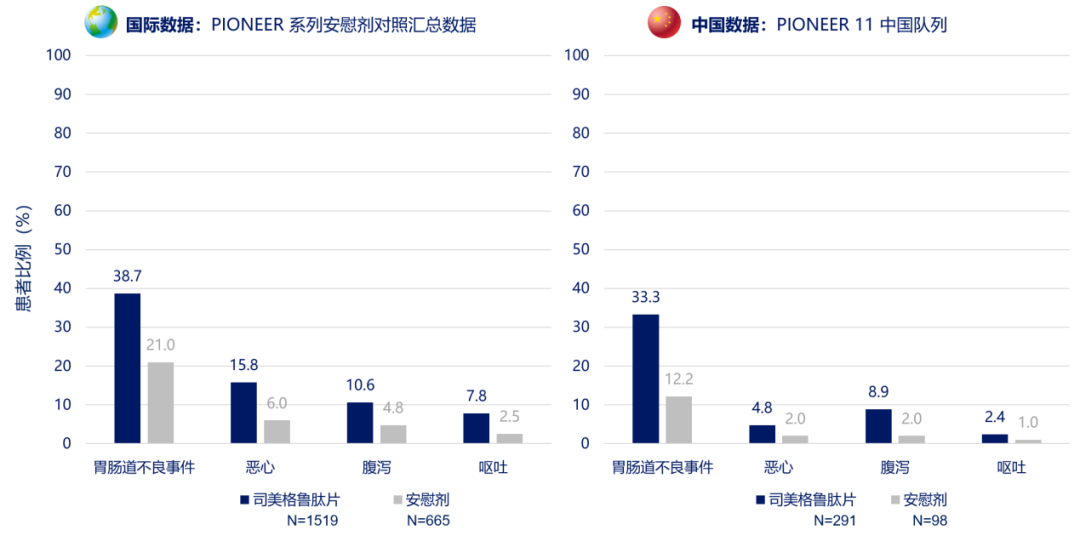
注:国际数据纳入了对照组包含安慰剂的研究 PIONEER 1,4,5,8;中国数据为 PIONEER 11 的中国亚组数据;司美格鲁肽片组数据为所有剂量组汇总数据
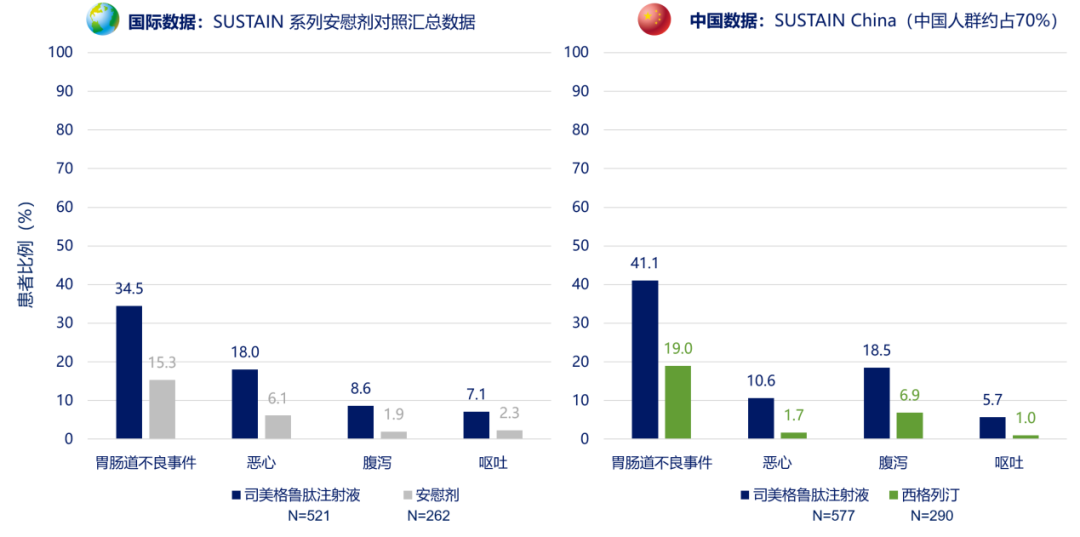
注:国际数据纳入了安慰剂对照研究 SUSTAIN 1,5;中国数据参考SUSTAIN China 总人群数据;司美格鲁肽注射液组数据为所有剂量组汇总数据
图 5. 司美格鲁肽片及司美格鲁肽注射液 Ⅲ 期临床研究中胃肠道不良反应的国内外数据[7,9,10]
PIONEER REAL 系列研究是司美格鲁肽片的多中心、前瞻性的非干预性的真实世界研究,在 2023 EASD 年会上已披露了一项加拿大的研究结果[11]。PIONEER REAL Canada 研究中随访 34~44 周,182 名受试者中胃肠道不良反应发生率为 26.9%[11]。司美格鲁肽片的大型优效性试验设计心血管结局试验——SOUL 研究(共纳入 9,650 例受试者,随访时间长达 5 年),将进一步探索长期使用司美格鲁肽片的胃肠道耐受情况[12]。
目前尚无针对合并上消化道疾病的 T2DM 患者司美格鲁肽片的疗效及安全性的临床试验,不过一项药代动力学研究提示:在合并轻中度上消化道疾病(指慢性胃炎/胃食管反流病)的 T2DM 患者中,与不合并上述疾病的 T2DM 患者相比,司美格鲁肽片的血浆暴露量相似[13](图 6)。且另一项药代动力学研究表明,是否服用质子泵抑制剂(奥美拉唑)对司美格鲁肽片的暴露量亦无显著影响[14]。
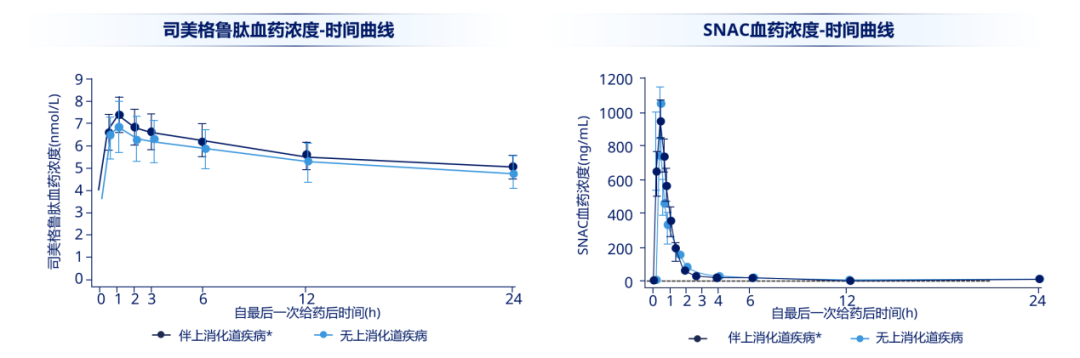
注:T2DM 受试者分为合并轻-中度上消化道疾病组(N = 36)和无上消化道疾病组(N = 19),空腹状态下连续 10 天口服司美格鲁肽片(1 次/天,前 5 天 3 mg,后 5 天 7 mg),* 慢性胃炎/胃食管反流病
图 6. 上消化道疾病对司美格鲁肽片的血浆暴露量无明显影响[13]
四问:
如何减轻 GLP-1RA 的胃肠道不良反应?
GLP-1RA 引起胃肠道反应的具体机制尚不明确。GLP-1 受体广泛分布于全身,GLP-1 可能通过直接作用于胃肠道中的 GLP-1 受体,抑制胃排空,从而使胃排空延迟,导致恶心、呕吐等胃肠道反应。此外, GLP-1 受体在脑内也有广泛分布,GLP-1 在中枢神经系统(延髓极后区的 GLP-1 受体)的直接作用也可引起恶心[5]。
《2020 年改善心血管和肾脏结局的新型抗高血糖药物临床应用中国专家建议》[15]、《2022 年 ADA/EASD 共识报告:2 型糖尿病高血糖的管理》[16]和 2020 年 JAMA Cardiology 刊发的 GLP-1RA 心内科用药指导[17]均指出:使用 GLP-1RA 治疗时的胃肠道反应呈剂量依赖性,随时间延长而减轻。临床使用时可从小剂量起始,逐渐加量,必要时减缓滴定速度,或进行饮食调整以减轻胃肠道反应。
2022 年发表于 Postgraduate Medicine 杂志的一篇综述提出:可采用以患者为中心的策略管理胃肠道反应,包括三个步骤:教育和解释;滴定至适当的剂量;对胃肠道反应的有效管理(图 7)[5]。
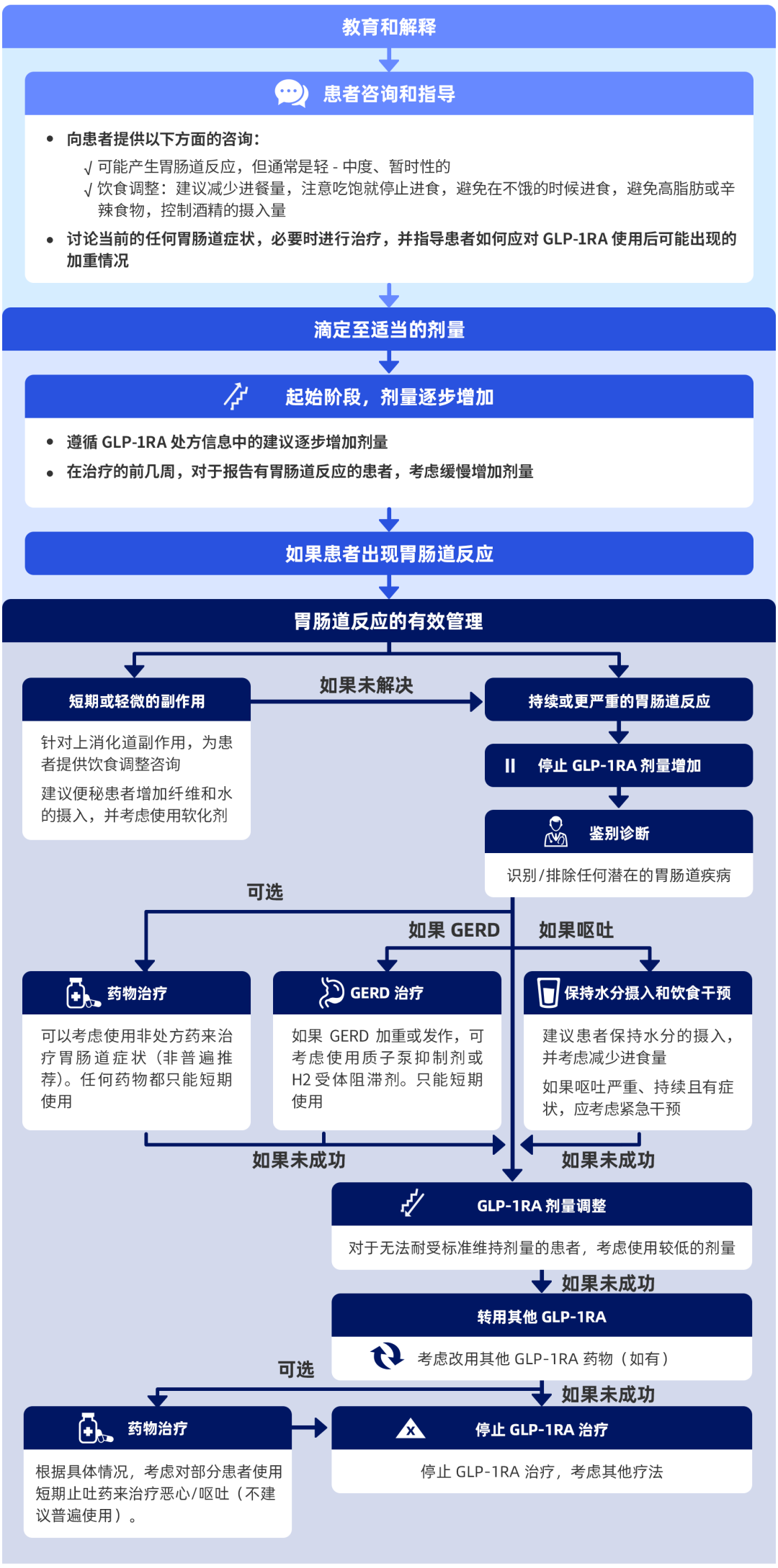
注:GERD:胃食管反流病
图 7. 以患者为中心的胃肠道反应管理[5]
总结
综上所述,创新技术 SNAC 帮助司美格鲁肽成功突破消化道壁垒,在胃内实现跨细胞吸收,该过程充分可逆。在司美格鲁肽片的系列 Ⅲ 期临床试验中未见新的胃肠道不良事件,PIONEER 系列研究中,中国人群胃肠道不良事件发生率与国际数据相似,且胃肠道不良反应主要类别及发生率与注射剂型司美格鲁肽相似。应对 GLP-1RA 胃肠道不良反应的 3 个关键环节包括患者教育、剂量滴定和症状处理。随着 GLP-1RA 的临床证据日益丰富,其在指南中的地位逐渐提升,司美格鲁肽片的出现无疑使更广大的 T2DM 患者得以早期使用 GLP-1RA。随着司美格鲁肽片在中国获批,相信未来中国临床医生会积累更加丰富的 GLP-1RA 用药经验,帮助广大 T2DM 患者从容化解 GLP-1RA 相关胃肠道不良反应的疑问。
本文仅供医疗卫生等专业人士参考
内容审核:陈妙锦
项目审核:龙瑞瑾
题图来源:图虫创意
参考文献:
[1] Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes[J]. European Heart Journal (2023) 00,1–98.
[2] American Diabetes Association Standards of Care in Diabetes-2023[J]. Diabetes Care.2023 Jan;47(Suppl 1):S1-S321.
[3] 中国心血管代谢联盟. 中国成人2型糖尿病及糖尿病前期患者动脉粥样硬化性心血管疾病预防与管理专家共识(2023)[J]. 中华心血管病杂志(网络版),2023,06(01):1-19.
[4] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华糖尿病杂志.2021.13(4):315-409.
[5] Wharton S, Davies M, Dicker D, et al. Managing the gastrointestinal side effects of GLP-1 receptor agonists in obesity: recommendations for clinical practice[J]. Postgrad Med. 2022 Jan;134(1):14-19.
[6] Buckley ST, et al. Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist[J]. Sci Transl Med. 2018 Nov 14;10(467):eaar7047.
[7] Weiqing Wang, et al. PIONEER 11: Efficacy and safety of oral semaglutide versus placebo in predominantly Chinese patients with type 2 diabetes treated with diet and exercise[J]. 2022 IDF. eposter presentation.
[8] Linong Ji, et al. PIONEER 12: Efficacy and safety of oral semaglutide vs sitagliptin in predominantly Chinese subjects with type 2 diabetes treated with metformin[J]. 2022 IDF. eposter presentation
[9] Aroda VR, Erhan U, Jelnes P, et al. Safety and tolerability of semaglutide across the SUSTAIN and PIONEER phase IIIa clinical trial programmes[J]. Diabetes Obes Metab. 2023 May;25(5):1385-1397.
[10] Ji L, Dong X, Li Y, et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as add-on to metformin in patients with type 2 diabetes in SUSTAIN China: A 30-week, double-blind, phase 3a, randomized trial. [J] Diabetes Obes Metab. 2021 Feb;23(2):404-414.
[11] Reichert SM, et al. Clinical outcomes associated with the use of oral semaglutide in an adult population with type 2 diabetes in Canada: a prospective real-world study (PIONEER REAL Canada) . presented at the EASE 2023, Hamburg, Germany.
[12] McGuire DK, Busui RP, Deanfield J, et al. Effects of oral semaglutide on cardiovascular outcomes in individuals with type 2 diabetes and established atherosclerotic cardiovascular disease and/or chronic kidney disease: Design and baseline characteristics of SOUL, a randomized trial. [J] Diabetes Obes Metab. 2023 Jul;25(7):1932-1941.
[13] Meier J J , et al. Effect of upper gastrointestinal disease on the pharmacokinetics of oral semaglutide in subjects with type 2 diabetes.[J] Diabetes Obes Meta. 2022 Apr;24(4):684-692.
[14] Bækdal TA, Breitschaft A, Navarria A, Hansen CW. A randomized study investigating the effect of omeprazole on the pharmacokinetics of oral semaglutide. [J] Expert Opin Drug Metab Toxicol. 2018 Aug;14(8):869-877.
[15] 《改善心血管和肾脏结局的新型抗高血糖药物临床应用中国专家建议》工作组. 改善心血管和肾脏结局的新型抗高血糖药物临床应用中国专家建议[J]. 中国循环杂志,2020,35(03):231-238.
[16] Davies MJ, Aroda VR, Collins BS, et al. Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). [J] Diabetologia . 2022 Dec;65(12):1925-1966.
[17] Honigberg MC, Chang LS, McGuire DK, Plutzky J, Aroda VR, Vaduganathan M. Use of Glucagon-Like Peptide-1 Receptor Agonists in Patients With Type 2 Diabetes and Cardiovascular Disease: A Review. [J] JAMA Cardiol. 2020 Oct 1;5(10):1182-1190.




發表評論 取消回复