這裡是《21健訊Daily》,歡迎與21世紀經濟報道新健康團隊共同關註醫藥健康行業最新事件!
一、政策動向
●國傢衛建委發佈《手術質量安全提升行動方案(2023-2025年)》
8月28日,國傢衛生健康委辦公廳發佈關於印發手術質量安全提升行動方案(2023-2025年)的通知。
為深入推進健康中國建設,進一步深化醫藥衛生體制改革,全面提升醫療質量安全水平,國傢衛生健康委、國傢中醫藥局聯合印發瞭《全面提升醫療質量行動計劃(2023-2025年)》,其中提出開展“手術質量安全提升行動”。
行動計劃目標提出,利用3年時間,進一步完善手術質量安全管理體系,形成科學規范、責權清晰、運行順暢的管理機制。到2025年末,住院患者圍手術期死亡、手術並發癥、麻醉並發癥等負性事件發生率進一步下降,非計劃重返手術室再手術率不高於1.8‰,住院患者手術後獲得性指標發生率不高於7.5‰,手術麻醉期間低體溫發生率、I類切口手術抗菌藥物預防使用率進一步降低,日間手術占擇期手術的比例進一步提高,四級手術術前多學科討論制度得到全面落實。
●國傢衛健委發佈《人間傳染的病原微生物目錄》
8月28日,國傢衛生健康委發佈關於印發人間傳染的病原微生物目錄的通知。
為加強與人體健康有關的病原微生物實驗室生物安全管理,規范病原微生物實驗活動、菌(毒)種和樣本運輸等行為,根據《中華人民共和國生物安全法》和《病原微生物實驗室生物安全管理條例》的規定,國傢衛健委在《人間傳染的病原微生物名錄》(衛科教發〔2006〕15號)的基礎上,組織制定瞭《人間傳染的病原微生物目錄》。
《名錄》中病毒為160種、附錄6種。修訂後的《目錄》中病毒為160種、附錄7種,其中危害程度分類為第一類的29種、第二類的51種、第三類的82種和第四類的5種。
一是新增危害程度分類為第二類的病毒5種,新增危害程度分類為第三類的病毒7種。刪除危害程度分類為第二類的病毒5種,刪除危害程度分類為第三類的病毒6種,刪除危害程度分類為第四類的病毒1種。將5種病毒的危害程度分類由第二類降為第三類,相應調整實驗活動和運輸管理要求。
二、藥械審批
●永泰生物細胞治療產品擬納入突破性治療品種
8月28日,中國國傢藥監局藥品審評中心(CDE)官網公示,永泰生物擴增活化的淋巴細胞擬納入突破性治療品種,擬定適應癥為:預防原發性肝細胞癌根治性切除術後復發。
公開資料顯示,該產品是永泰生物的核心產品EAL,目前正在進行確證性2期臨床試驗,有望成為一款用於治療實體瘤的個體化免疫細胞藥物。
原發性肝癌起源於肝臟的上皮或間葉組織,肝炎、長期飲酒、吸煙等是常見致病因素。目前,肝癌的治療包括手術、放化療、介入、靶向藥物、免疫治療等多種手段。雖然CIK細胞已被寫入中國臨床腫瘤學會(CSCO)原發性肝癌診療指南2022 II級推薦,但是中國目前尚無獲批的用於實體瘤的免疫細胞治療產品。
●和鉑醫藥ADC藥物在美獲批臨床試驗
8月28日,和鉑醫藥宣佈,已獲美國食品及藥物監督管理局(FDA)的新藥研究申請許可(IND)在美國啟動抗體偶聯藥物(ADC)HBM9033的臨床試驗。
HBM9033特異性靶向人間皮素(Mesothelin, MSLN),該腫瘤相關抗原在包括間皮瘤,卵巢癌,肺癌,乳腺癌和胰腺癌等多種實體瘤中上調。HBM9033中的全人源單克隆抗體由Harbour Mice®平臺產生,與可溶性MSLN相比,其能更好地與膜結合型MSLN結合並最大限度減少遊離型MSLN的幹擾。
三、資本市場
●樹立醫療赴港遞交IPO申請
8月28日,樹蘭醫療管理股份有限公司 Shulan Health Management Co., Ltd.(以下簡稱"樹蘭醫療") 向港交所遞交招股書,擬在香港主板掛牌上市。
樹蘭醫療是一傢集健康醫療服務、醫學科研、醫學教育為一體的中國科技型社會辦醫療集團,擁有及運營3傢社會辦綜合醫療機構,並已向中國14傢合作醫院提供醫院管理服務(截至2023年3月31日)。
根據弗若斯特沙利文的資料,於2022年按收入計,樹蘭醫療為華東地區最大型的社會辦醫療機構,在屬於中國“雙一流大學”或“國傢重點學科大學”的高校教學醫院或附屬醫院的社會辦醫療機構中排名第一。
財務數據顯示,在過去的2020年、2021年、2022年和2023年前三個月,樹蘭醫療的營業收入分別為16.18億 、15.48億、17.78億和4.86億元人民幣,相應的凈利潤分別為6,411.2萬、-8,228.9萬、-11,088.1萬和-3,154.5萬元人民幣,相應的經調整凈利潤分別為12,221.8萬、2,117.7萬、630.4萬和482.1萬元人民幣。
●漫迪醫療完成近億元A+輪融
近日,國內領先的生物磁設備廠商漫迪醫療完成近億元A+輪融資,本輪由新鼎資本獨傢投資。本輪融資金額將主要用於心磁技術的研發迭代,開展大規模的MCG臨床研究並推動國內心磁臨床標準的建立,以及用於早期先天性心臟疾病檢查的胎兒心磁圖儀(fMCG)的臨床試驗註冊工作。此前,漫迪醫療已獲得包括聯新資本、中賽資本、國鑫資本及中國科學院旗下多個機構的投資。
漫迪醫療儀器(上海)有限公司由中國科學院上海微系統與信息技術研究所科學傢團隊和歸國科學傢依托於國傢863計劃心磁項目於2009年發起成立,專註於生物磁設備的研發、生產和銷售,致力於成為國際生物磁領域的領先企業。
四、行業大事
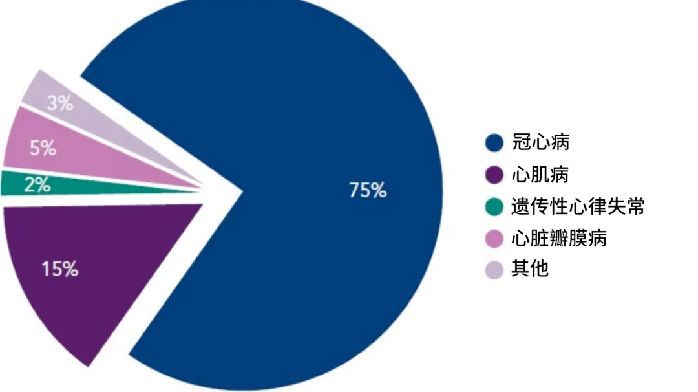
●聯拓生物肥厚型心肌病新藥臨床III期試驗完整數據公佈
8月28日,致力於為中國和其他亞洲主要市場的患者帶來創新藥物的生物技術公司聯拓生物(納斯達克:LIAN)宣佈,mavacamten(瑪伐凱泰)治療中國有癥狀的梗阻性肥厚型心肌病(oHCM)患者的 EXPLORER-CN III期臨床試驗數據在2023年歐洲心臟病學會年會Late-Breaking專場上公佈,並以《Effect of Mavacamten on Chinese Patients With Symptomatic Obstructive Hypertrophic Cardiomyopathy》為題同步發表於《JAMA Cardiology》。
聯拓此前公佈瞭EXPLORER-CN研究的頂線數據。該研究達到瞭主要終點,即mavacamten在Valsalva左心室流出道(LVOT)峰值壓差方面顯示出具有統計學和臨床意義的改善。此外,在所有次要終點方面mavacamten均顯示出改善,包括左心室流出道梗阻、臨床癥狀和健康狀況。
●輝瑞創新蛋白降解療法在華啟動3期臨床
據中國藥物臨床試驗登記與信息公示平臺官網公示,輝瑞(Pfizer)在中國啟動瞭蛋白降解靶向嵌合體vepdegestrant片的3期臨床 ,擬用於ER+/HER2-乳腺癌一線治療。
Vepdegestrant最初由Arvinas公司開發,2021年,輝瑞與Arvinas公司達成超20億美元的合作,以共同開發和商業化該產品。此外,輝瑞還在中國啟動瞭人源化幹擾素β(IFN-β)抗體PF-06823859的3期臨床,擬用於治療活動性特發性炎癥性肌病。
Vepdegestrant的潛力已在臨床試驗中得到初步驗證。1期臨床試驗數據顯示,無論腫瘤表達野生型ER還是突變型ER,vepdegestrant最高可將ER水平降低90%。在34名可以評估臨床獲益的患者中,臨床獲益率為41%。
●生命科學巨頭丹納赫將以57億美元收購Abcam
據最新報道,8月28日,丹納赫宣佈以每股24美元的現金收購Abcam,總交易價值約57億美元,預計於2024年中完成。該交易已經獲得兩方董事會一致通過。Abcam預計將在丹納赫的生命科學部門作為一傢獨立的運營公司和品牌運營。
Abcam成立於1998年,總部位於英國劍橋,主要銷售用於藥物發現、研究和診斷的抗體、試劑、生物標志物和檢測試劑盒等,目前擁有約75萬名客戶。
Abcam此次動作發生在其董事會一致決定探索戰略選擇(包括潛在出售)兩個月後。今年六月,Abcam就表示,它正在研究“最大限度提高股東價值的各種選擇”,而過去幾周內,它已經收到瞭來自多方的幾次“戰略詢問”。



發表評論 取消回复