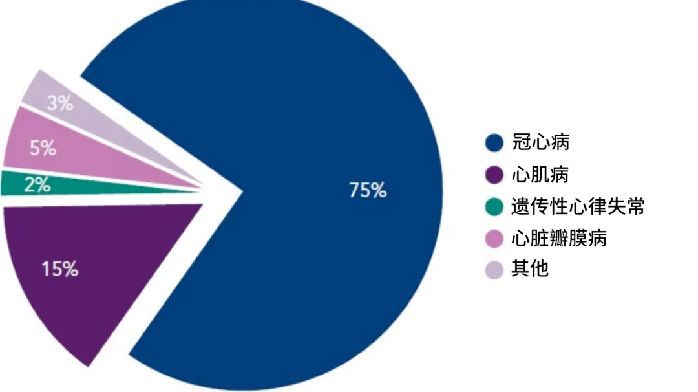
一、政策動向
●國傢藥監局通報江西美琳康大藥業飛檢結果
7月19日,國傢藥監局發佈關於江西美琳康大藥業股份有限公司檢查情況的通告(2023年第32號)。
近期,國傢藥品監督管理局組織檢查組對江西美琳康大藥業股份有限公司進行瞭飛行檢查。檢查發現該企業質量管理體系主要存在以下缺陷:
一、廠房與設施方面
企業環氧乙烷滅菌室和解析室兩室互通,無物理隔離,存在交叉污染風險,不符合《醫療器械生產質量管理規范》和《醫療器械生產質量管理規范附錄無菌醫療器械》(以下簡稱《規范》及無菌附錄)中廠房與設施應當根據所生產產品的特性、工藝流程及相應的潔凈級別要求進行合理設計、佈局和使用的要求。
二、設計開發方面
企業原材料無紡佈新增加的供應商與原供應商提供的原材料質檢報告所用標準不一致,且未開展相關驗證,不符合《規范》及無菌附錄中當選用的材料、零件或者產品功能的改變可能影響到醫療器械產品安全性、有效性時,應當評價因改動可能帶來的風險,必要時采取措施將風險降低到可接受水平,同時應當符合相關法規的要求。
該企業質量管理體系存在嚴重缺陷,不符合《規范》及無菌附錄相關規定,該企業已對其質量管理體系存在的上述缺陷予以確認。
江西省藥品監督管理局應當按照《醫療器械監督管理條例》第七十二條規定,對企業依法采取暫停生產的控制措施,對涉及違反《醫療器械監督管理條例》及相關規定的,應當依法處理;並責令該企業評估產品安全風險,對有可能導致安全隱患的,按照《醫療器械召回管理辦法》的規定召回相關產品。
該企業完成全部項目整改並經江西省藥品監督管理局復查合格後方可恢復生產。
●國傢藥監局發佈《進一步加強和完善醫療器械分類管理工作的意見》
7月19日,國傢藥監局發佈關於進一步加強和完善醫療器械分類管理工作的意見。
意見指出,分類管理是醫療器械監管的重要基礎性制度。近年來,我國醫療器械分類管理改革持續推進,管理制度與運行機制不斷完善,分類規則與分類目錄適時修訂,監管效能和產業發展得到有力提升。隨著醫療器械相關科技和產業高速發展,醫療器械監管工作面臨新形勢新任務新要求,分類管理工作流程有待進一步優化,支撐能力有待進一步提升,分類管理制度執行有待進一步嚴格。
意見明確,細化分類原則要求。完善由分類規則、分類界定指導原則、分類目錄組成的分類管理制度體系。研究修訂《醫療器械分類規則》,為有序調整產品類別奠定基礎。針對新材料、高新技術等領域,聚焦監管熱點問題、共性問題和急需問題,在分類規則框架下研究細化分類界定指導原則,統一相關領域產品分類界定原則和尺度,服務產業高質量發展。
修訂完善分類目錄。依據《體外診斷試劑分類規則》,修訂體外診斷試劑分類目錄,完善分類框架,細化分類層級,規范預期用途,擴充代表性產品,擴大目錄覆蓋面。完善《醫療器械分類目錄》《第一類醫療器械產品目錄》,強化產品分類與通用名稱命名有機銜接,建立醫療器械分類命名數據庫,保障分類及命名規則有效實施。
二、藥械審批
●君實生物抗PD-1單抗在國內遞交第10項上市申請
7月19日,君實生物宣佈,中國國傢藥品監督管理局藥品審評中心(CDE)受理瞭抗PD-1單抗藥物特瑞普利單抗的新適應癥上市申請,聯合依托泊苷和鉑類用於廣泛期小細胞肺癌一線治療。公開資料顯示,這是特瑞普利單抗在中國遞交的第10項上市申請。
●微芯生物“西達本胺”新適應癥申報上市
7月18日,微芯生物宣佈,由該公司研發的亞型選擇性組蛋白去乙酰化酶(HDAC)口服抑制劑西達本胺聯合R-CHOP(利妥昔單抗、環磷酰胺、阿黴素、長春新堿和強的松)用於既往未經治療的MYC和BCL2表達陽性的彌漫大B細胞淋巴瘤(DLBCL)患者的上市申請獲得中國國傢藥監局(NMPA)受理。
三、資本市場
●恒宇醫療完成C+輪融資
近日,天津恒宇醫療科技有限公司(以下簡稱“恒宇醫療”)宣佈完成新一輪由金匯通基金進行的獨傢投資。此前,繼2022年1月C輪融資後,恒宇醫療相繼完成瞭由老股東天士力資本持續追加的投資和由華泰紫金領投,阿裡巴巴跟投的C+輪投資,累計完成超億元人民幣融資,浩悅資本持續擔任獨傢財務顧問。本輪融資將助力研發、生產和註冊,並加速推進上市產品的商業化落地。
天津恒宇醫療成立於2016年,專註於血管內超聲(Intravascular Ultrasound,IVUS)設備及導管、光學相幹斷層成像(Optical Coherence Tomography, OCT)設備及導管、IVUS/OCT一體機式的雙導管系統、基於IVUS和OCT的無創血流儲備分數(Fractional Flow Reserve, FFR)平臺、融合OCT與近紅外光譜(Near-Infrared Spectroscopy, NIRS)的單光源雙模態OCT-NIRS技術及血管內激光斑塊消蝕技術的自主研發、生產和銷售,掌握光學、超聲及導管平臺技術,並不斷基於底層技術進行全球領先的創新,致力於為醫患提供以影像類產品為基礎的泛血管一體化解決方案。
●磅策醫療宣佈完成近億元A+輪融資
7月19日消息,磅策醫療宣佈完成近億元A+輪融資,本輪融資由深圳市創新投資集團領投,華醫資本跟投,探針資本擔任獨傢財務顧問,所募集資金將用於產品研發、臨床認證、產能強化及全球化推廣。據磅策醫療介紹,這是該公司繼去年完成數千萬元A輪融資後獲得新一輪融資,證明公司的技術、產品實力和發展潛力受到廣泛認可。
磅策醫療成立於2019年,是哈工大機器人體系孵化的專註醫療機器人的公司。該公司研發團隊通過挖掘亟須解決的共性臨床需求,應用機器人技術制造更專業化的細分領域機器人。該公司產品管線覆蓋嚴肅醫療和消費醫療領域,現有植發機器人、手術機器人穿刺導航系統等產品,涵蓋醫美、腫瘤等領域。
四、行業大事
●強生就藥品價格談判起訴美國政府
7月18日,強生公司以《通脹削減法案》(IRA)中的藥品價格談判條款違憲為由,向美國政府提起訴訟,成為第四個就IRA中的藥品價格談判起訴美國政府的大型制藥公司。其餘三傢是默沙東、百時美施貴寶和安斯泰來。
在新澤西州的美國地方法院,強生表示,由醫療保險進行的價格談判將違反美國憲法第一和第五修正案。這與默沙東、百時美施貴寶和安斯泰來在各自的訴訟中提出的理由相同。
強生在一份新聞稿中表示,政府正迫使強生以法律規定的顯著低於市場價的價格提供其創新的專利藥物,這將破壞公司目前為患者提供開創性療法的醫藥創新周期,並警告IRA的影響將溢出到非醫療保險市場。
●斯微生物腫瘤新抗原mRNA疫苗啟動IIT臨床研究
7月18日,斯微生物在Clinicaltrials.gov網站上註冊瞭腫瘤新抗原mRNA疫苗治療晚期惡性腫瘤的IIT臨床研究,合作方為北京大學腫瘤醫院。
該研究計劃入組20例PD-1/PD-L1抗體耐藥的患者,與信達生物PD-1抗體聯用,預計2025年底初步完成。
目前,國內腫瘤新抗原mRNA疫苗方面,僅立康生命、新合生物申報IND,斯微生物則進入IIT臨床研究。



發表評論 取消回复