
央視網消息:7月5日,國傢藥監局副局長黃果在國務院新聞辦公室召開的“權威部門話開局”系列主題新聞發佈會上指出,近年來,國傢藥監局以深化審評審批制度改革為契機,努力加快罕見病藥品上市速度,努力讓更多的罕見病患者有藥可用。2018年起,國傢藥監局就建立瞭專門通道,對我國包括罕見病用藥在內的臨床急需境外新藥,實行單獨排隊、鼓勵申報、加快審批。根據上述政策,已有23個進口罕見病新藥通過專門通道獲批上市。2020年,我們進一步明確瞭優先審評程序,將具有明顯臨床價值的防治罕見病新藥,納入優先審評審批程序。目前,在所有藥品上市申請中,罕見病新藥的審評審批時限是最短的。
針對罕見病單病種發病率極低,藥物研究難度遠遠超過常見多發病的特殊性,國傢藥監局對治療罕見病的創新藥給予政策傾斜,藥品審評機構對罕見病新藥實行早期介入、研審聯動、全程服務,組建審評團隊跟進罕見病藥物研發創新,允許企業滾動遞交研究資料,在溝通交流、核查檢驗、綜合審評等重點環節建立瞭無縫銜接機制。這些做法,可以很大程度上提升罕見病新藥的研發質量和效率。
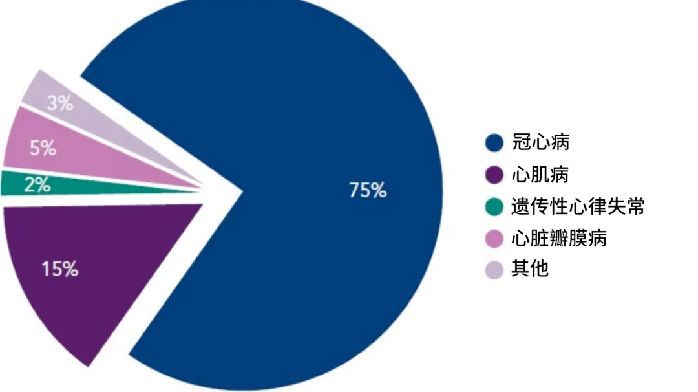
通過綜合施策,近年來,我國罕見病用藥的上市數量和速度實現瞭“雙提升”。2018年以來,我國批準上市的進口和國產罕見病用藥共計68個。下一步,國傢藥監局將繼續高度關切罕見病患者需求,在確保上市藥品安全、有效、質量可控的基礎上,加快罕見病藥品審評審批,為罕見病患者延緩病情發展、提高生活質量作出最大努力。



發表評論 取消回复