我國是食管癌高發國傢,食管癌具有明顯的中國特色,揭秘食管癌的遺傳變異和分子特征,探索食管癌的綜合治療策略,是我國科學傢、醫學傢、企業傢的重要責任。
第十三屆北京消化腫瘤國際高峰論壇暨中國胃腸腫瘤臨床研究協作組(CGOG)第十三屆年會於 2023 年 6 月 7-11 日在北京順利召開。丁香園特別欄目「丁香大咖時間」,特邀中國工程院詹啟敏院士就中國特色食管鱗癌的精準診療分享經驗觀點,共同助力中國醫生成長!

中國高發特色腫瘤之食管鱗癌
食管癌發病率占全球惡性腫瘤發病率的第八位,死亡率占全球惡性腫瘤死亡率的第六位,總體五年生存率為 10%~30%,嚴重威脅著人類健康。作為中國特色腫瘤之一的食管癌,在中國有哪些獨特之處呢?
①、食管癌在世界范圍內以高加索地區、非洲為高發地區,包括伊朗、土耳其、伊拉克、蒙古等;在國內又以閩粵一帶、太行山區、新疆地區的發病率較高,包括河南、山西、廣東、新疆等。
②、全球一半以上的食管癌患者在中國,發病人數和死亡人數均占全球約 55%。
③、在我國惡性腫瘤中,食管癌發病率居第六位,死亡率居第四位,呈高發病率、高死亡率的趨勢。
④、我國食管癌 90% 以上的病理類型為鱗癌,而歐美國傢病理類型以腺癌為主。
⑤、我國食管鱗癌發病部位以食管胸段為主,而歐美國傢食管腺癌多位於胃食管交界處。
⑥、我國食管癌確診時多屬晚期,以綜合治療為主,而歐美國傢食管癌分期相對較早,以手術治療為主。
這一切除瞭與東西方飲食結構存在差異有關,如我國食管癌病因多為維生素攝入不足及不良飲食習慣,而歐美國傢則為吸煙飲酒肥胖所致,還可能與東西方人群特征、遺傳背景存在差異有關。
多組學聯合分析首次揭示中國食管鱗癌分子分型
早在 10 年前,北京大學國際癌癥研究院的詹啟敏院士就帶領團隊從臨床實際問題出發,建立瞭國內最大規模食管鱗癌隊列,進而探索我國食管鱗癌的基因組遺傳變異特征。
該研究首次揭示瞭食管鱗癌基因組變異特征,系統闡釋表觀遺傳調控分子的異常,發現食管鱗癌 DNA 損傷的可能源頭,鑒定出 8 個關鍵驅動基因和多個重要基因的拷貝數變異,對深入研究食管癌發病機制、藥物研發及個性化治療方法提供科學依據,具有開創性意義,在國際上引起廣泛關註。

而今,詹啟敏院士團隊與他的合作者再度通過整合全基因組、表觀遺傳組、轉錄組和蛋白質組等多組學數據,從分子和微環境角度出發,首次識別出中國食管鱗癌的四種主要分子亞型,對食管鱗癌的精準治療策略具有重要指導意義。
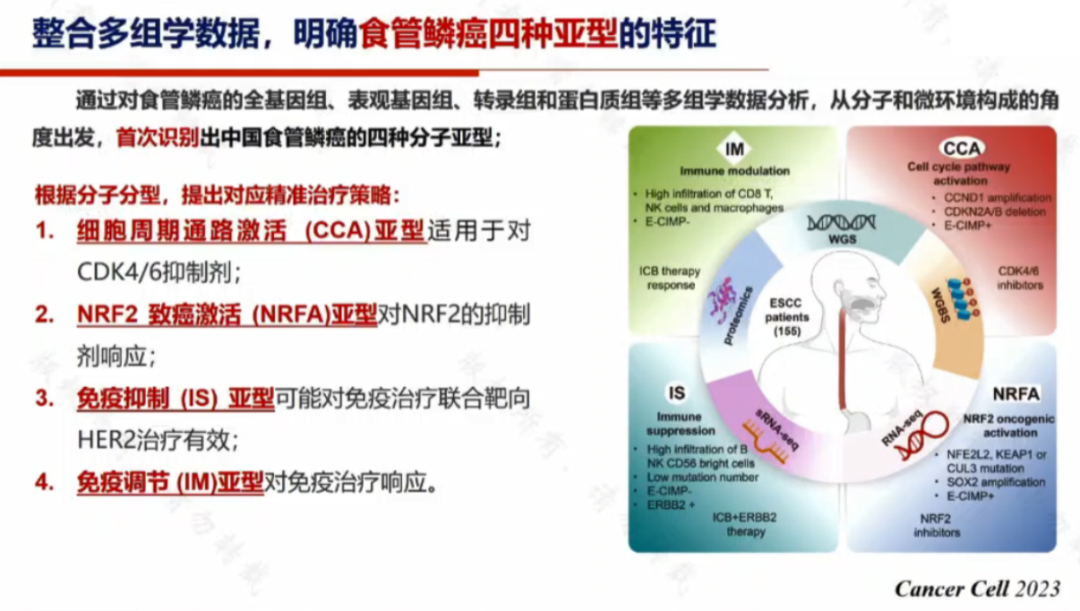
一、細胞周期通路激活(CCA)亞型:CCA 亞型的主要特征為細胞周期相關基因的改變,包括 11q13.3/CCND1 的擴增以及 CDKN2A 的缺失;該型對 CDK4/6 抑制劑敏感。
二、NRF2 致癌激活(NRFA)亞型:NRFA 亞型的特點主要四 NRF2 途徑的基因變異,包括 NFE2L2、KEAP1、CUL3 以及 SOX2,存在頻繁的突變以及拷貝數變異;該型對 NRF2 抑制劑響應較好。
三、免疫抑制(IS)亞型:IS 和 IM 亞型均為免疫細胞高浸潤型,但腫瘤組織浸潤的免疫細胞類型不同;IS 亞型可能對免疫治療聯合靶向 HER2 治療有效。
四、免疫調節(IM)亞型:IM 亞型患者可能對單藥免疫檢查點抑制劑的響應更優;基於 IM 分型開發瞭一個分類器可以有效預測抗 PD-1 免疫治療的反應。
泛癌種惡液質潛在治療靶點:P4HB
惡液質是臨床腫瘤患者死亡的重要原因,約有 30% 腫瘤患者直接死於惡液質,其中食管癌、胃癌患者的發生率可高達 43%~79%,主要表現為進行性體重減輕(包括骨骼肌丟失和脂肪丟失)和廣泛的炎癥狀態。
目前關於惡液質發展發展的分子機制仍不清楚,探索腫瘤惡液質的分子靶點及有效治療措施對於晚期惡性腫瘤患者的長期生存具有重要意義。
近年來,詹啟敏院士團隊同樣對腫瘤惡液質進行瞭深入研究,發現瞭一種驅動惡液質的新分子細胞外囊泡蛋白 P4HB,為腫瘤惡液質的診斷和治療提供瞭新思路。
該研究團隊通過構建癌惡液質動物模型,發現 P4HB 在食管鱗癌、胃腺癌、胰腺癌、肺癌細胞及分泌的外泌體中均高表達。高表達 P4HB 的外泌體可促進肌肉細胞凋亡和抑制肌肉細胞增殖,促進骨骼肌降解,縮短小鼠生存期。這提示 P4HB 可能是泛癌種惡液質的一個關鍵因素。
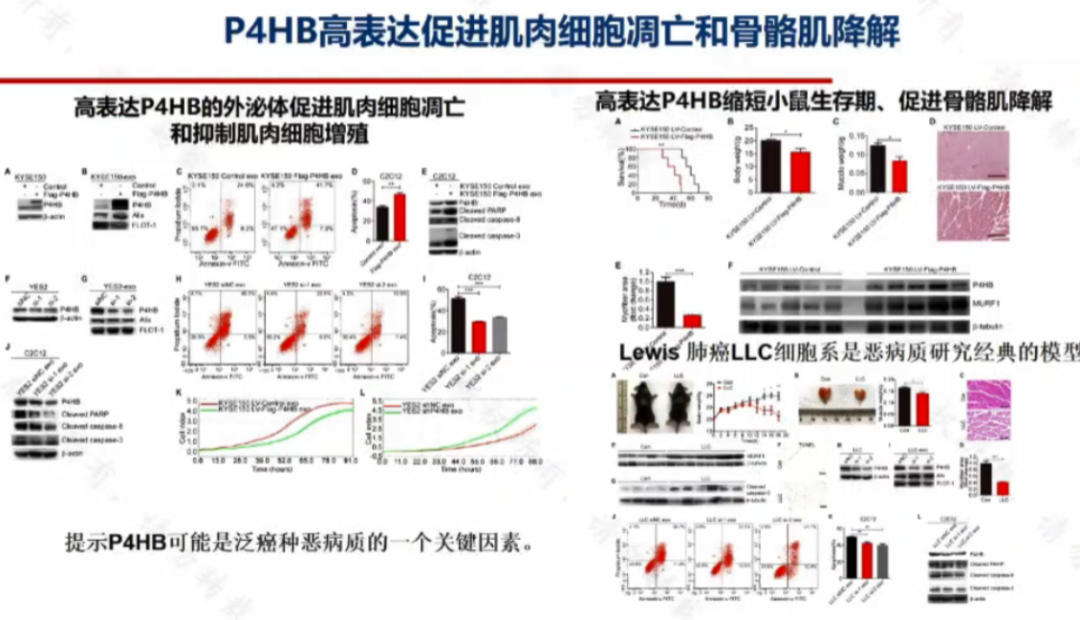
進一步的機制探索發現,P4Hb 通過增加磷酸甘油酸脫氫酶(PHGDH)的泛素化降解進而下調 PHGDH 蛋白水平;敲降 PHGDH 後通過激活泛素化通路降低瞭抗凋亡蛋白 Bcl-2 穩定性,從而降低其表達,導致 Caspase3 的表達上調,最終誘導凋亡。動物實驗表明,使用 P4HB 的小分子抑制劑 CCF642 可緩解小鼠體重減輕和骨骼肌降解。
該研究首次證實 P4HB 通過調控 PHGDH/Bcl-2/Caspase-3 通路誘導骨骼肌萎縮和惡液質現象,靶向 P4HB 可逆轉肌肉萎縮,為開發靶向治療方法逆轉惡液質提供瞭理論依據,具有轉化前景,目前已進入臨床實驗階段。
腸道菌群與腫瘤治療
腸道菌群不僅在調控宿主的生長、發育、營養代謝以及免疫穩態方面具有重要的作用,同樣在消化道腫瘤的發生發展發揮瞭重要作用,特別是在中空臟器如結直腸癌患者中,腸道菌群的失調能夠通過影響腸道代謝、腸道穩態以及腸道免疫等方面促進或者抑制腫瘤的發生發展,甚至影響抗腫瘤治療的療效及不良反應。
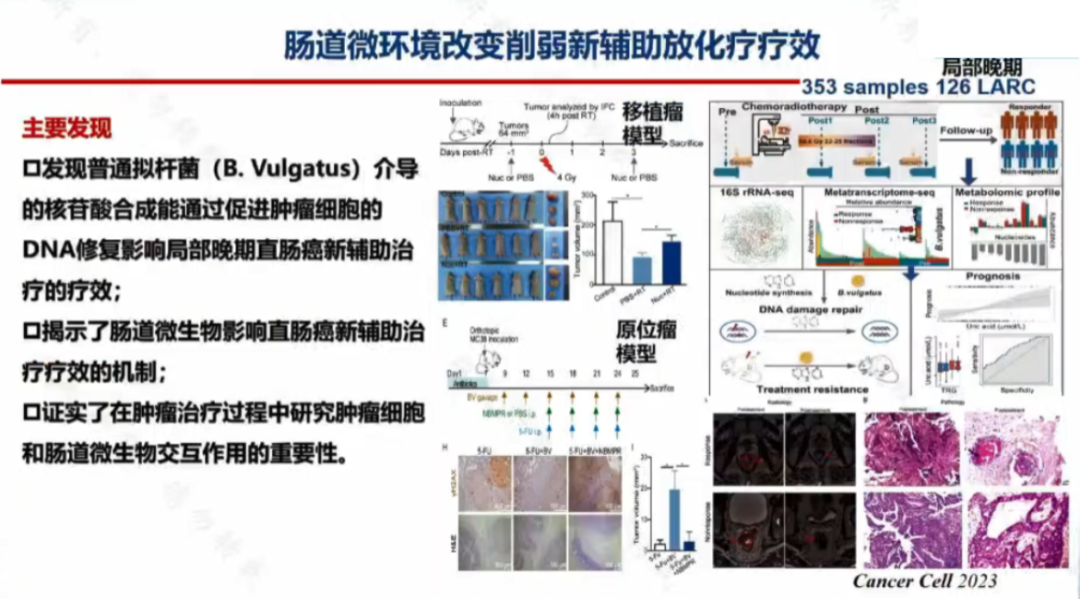
詹啟敏院士團隊通過研究發現,腸道微環境改變可以削弱結直腸癌新輔助放化療導的療效。腸道普通擬桿菌(B. Vulgatus)介導的核苷酸合成能通過促進腫瘤細胞的 DNA 修復影響局部晚期直腸癌患者新輔助治療的療效。
總結
食管鱗癌的發生發展是多種因素共同作用的結果,具有高度異質性。近年來,基因組學、表觀組學、轉錄組、蛋白組學、微生物組學以及生物信息分析技術等多組學技術的發展,為全方面深入剖析食管鱗癌的遺傳變異、分子特征提供瞭先進的武器,為食管鱗癌的預防、篩查、早期診斷和精準治療提供瞭重要的理論基礎,更向臨床研究轉化邁出瞭堅實的一步。
整理:黃玉庭;審核:詹啟敏院士
編輯:景勝傑
參考文獻:
1、Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-249.
2、Wang QL, Xie SH, Wahlin K, Lagergren J: Global time trends in the incidence of esophageal squamous cell carcinoma. Clin Epidemiol 2018, 10:717-728.
3、Chrysostomou D, Roberts LA, Marchesi JR, Kinross JM. Gut Microbiota Modulation of Efficacy and Toxicity of Cancer Chemotherapy and Immunotherapy. Gastroenterology. 2023 Feb;164(2):198-213.
4、Cancer Genome Atlas Research, N. et al. Integrated genomic characterization of oesophageal carcinoma. Nature. 2017 Jan 12;541(7636):169-175.
5、Salem ME, Puccini A, Xiu J, et al. Comparative Molecular Analyses of Esophageal Squamous Cell Carcinoma, Esophageal Adenocarcinoma, and Gastric Adenocarcinoma. Oncologist. 2018;23(11):1319-1327.
6、Shah MA, Kennedy EB, Catenacci DV, et al: Treatment of Locally Advanced Esophageal Carcinoma: ASCO Guideline. J Clin Oncol 2023, 38(23):2677-2694.
7、Andrews MC, Reuben A, Gopalakrishnan V, et al. Concepts Collide: Genomic, Immune, and Microbial Influences on the Tumor Microenvironment and Response to Cancer Therapy[J]. Front Immunol, 2018, (9) 946.



發表評論 取消回复