上消化道腫瘤是我國的高發腫瘤,患者人群占全球 50% 以上。但幾十年來,相較其他實體腫瘤,食管癌及胃癌治療領域的突破相對緩慢。
第十三屆北京消化腫瘤國際高峰論壇暨中國胃腸腫瘤臨床研究協作組(CGOG)第十三屆年會於 2023 年 6 月 7-11 日在北京順利召開。大會主席北京大學腫瘤醫院沈琳教授特別分享瞭「挫折中思考與實踐 —— 上消化道腫瘤精準治療如何破局」的主題報告,就這一問題進行瞭深入的講解分析,丁香園腫瘤時間整理總結如下:

沈琳教授認為,食管癌及胃癌治療領域的突破相對緩慢,這與諸多可能因素相關:
1、瞭解少、研究少:上消化道腫瘤異質性高、精準靶點少,同時相較其他瘤種全球關註度較少。
2、疾病復雜:上消化道腫瘤為空腔臟器,腹膜轉移,現有評價系統無法進行精準評估。
3、診斷晚:上消化道腫瘤患者通常癥狀隱匿,早診困難,而晚期生物學行為改變,治愈率低。
4、隊列少、標準化弱:缺乏臨床隊列及轉化平臺。總體而言,缺乏精準治療靶點和治療藥物。
因此,關鍵在於重新認識消化道腫瘤的臨床與分子特征,聚焦臨床問題,探索系統的精準治療與轉化研究的治療體系。
開展臨床研究:建立標準化隊列
沈琳教授提到,在中國開展臨床研究,不缺入組患者,但缺乏臨床標準化診療研究隊列的建立。北京大學腫瘤醫院的優勢在於臨床診療規范、統一治療、MDT 優秀,同時在患者、機構和企業中建立瞭良好的口碑和信譽,這成為開展前瞻性、大樣本、多中心、隨機對照臨床研究的基礎。
沈琳教授作為全球項目的中國區 PI、中國地區為主的 leaidng PI,牽頭瞭多項國際、國內的多中心臨床研究(Checkmate-649、Keynote-181、Keynote-590、Orient-15、Rational-302 等),研究結果發表在 Lancet、JCO、BMJ 等國際頂級期刊上。沈琳教授團隊牽頭的一系列研究已經成功改寫國際國內診療指南,使免疫治療成為胃、食管癌從二線到一線的標準治療,顯著改善患者生存率,使得胃食管癌死亡風險下降 30%-40%。
臨床試驗的探索從未停止。北京大學腫瘤醫院牽頭的 SKYSCRAPER-08 研究,作為首個探索 PD-L1 單抗聯合 TIGIT 單抗聯合化療一線治療晚期食管鱗癌的研究,目前已經入組結束,等待後續隨訪結果。
晚期胃癌領域,沈琳教授團隊正在開展基於 PD-L1 表達分層的 PD-L1 單抗(CS1001)聯合化療一線治療胃癌的多中心 3 期臨床研究,該研究結果預計在近期公佈。
在局部進展期胃癌患者中,沈琳教授及季加孚教授團隊歷時 13 年時間完成的 RESOLVE 研究建立瞭我國胃癌圍手術期的標準化療方案。而在此基礎上,沈琳教授再次設計瞭化療聯合免疫治療(斯魯利單抗)在圍術期的胃癌患者中的應用,該研究並未選擇所有患者,而是將入組標準限定為 PD-L1 CPS≥5 的患者。
沈琳教授提到:「胃癌的臨床研究設計應當追求精準,一項圍術期的研究大致需要經歷 7-8 年,臨床醫生的職業生涯又能有幾個 7-8 年?」她也強調「但人群選擇的標準並不是一成不變的,需要根據臨床前研究來決定。」
同樣,在局部進展期食管癌患者中,化療聯合免疫治療(特瑞普利單抗)的研究也在積極進行,預計能夠將 pCR 率提高 5 倍以上,改變食管癌圍術期治療方案指日可待。
早期臨床研究:回到實驗室尋求答案
沈琳教授提到,大樣本隨機對照臨床研究的機會可遇不可求。等待新藥上市再進行臨床試驗往往容易陷入被動,而因為消化系統腫瘤的復雜性,企業往往不願意首先開展臨床試驗。因此要想早期接觸新藥,應當踏入早期臨床研究領域,尋找合適腫瘤治療的藥物;同時也應當建立擬人化模型及研究平臺,做足臨床前工作、減少失敗概率、探尋耐藥機制、實現精準治療,才可能真正實現可持續發展。
北京大學腫瘤醫院消化腫瘤內科開展的早期臨床研究總計 82 項,其中牽頭 73 項,涉及靶點 60 個以上,許多研究都已展露可觀前景,推進到關鍵性研究和隨機對照研究中。通過早期臨床研究,也將許多產品推進到其他實體瘤如泌尿生殖系統腫瘤的研究當中,甚至已經獲得瞭突破性進展和臨床獲益。
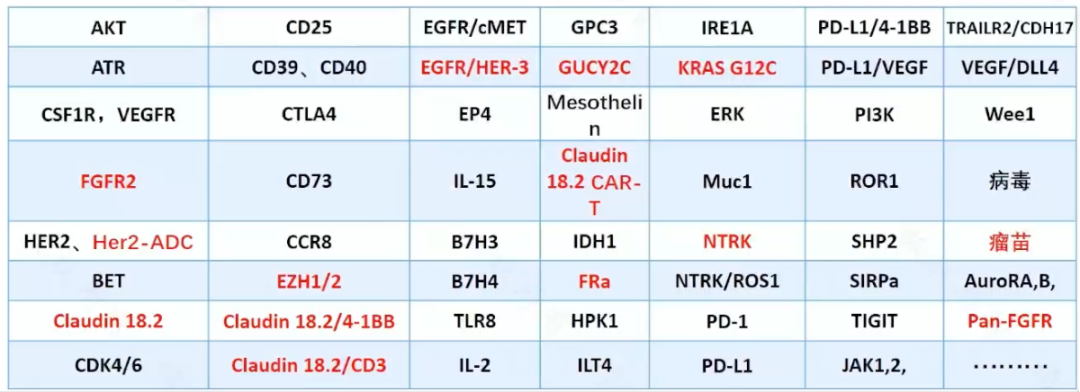
圖 1:沈琳教授團隊開展的早期臨床研究項目,標紅為目前已有較好前景的方向
失敗的臨床試驗往往能帶來諸多思考與靈感。靶向 HER2 的 ADC 類藥物 TDM-1 在乳腺癌中取得成功但在胃癌中失敗,因此國產 ADC 類藥物 RC48 上市後未在胃癌患者中嘗試開展臨床試驗。沈琳教授團隊通過臨床前研究,發現 PDX 模型中 RC48 不僅抑制 HER2 高表達的腫瘤,也對中低表達組有效。這為後續的臨床研究設計確定瞭入組人群,隻要存在 HER2 膜蛋白表達即可納入研究,而並不要求 FISH 陽性。該研究促使 RC48 成為中國獲批的首個用於治療胃癌的國產 HER2 ADC 類藥物,也推動其成為 HER2 陽性患者晚期胃癌的三線治療。研究中還發現 RC48 在 3 例尿路上皮癌中全部有效,目前已交由郭軍教授團隊深入研究,已經取得瞭突破性的進展。
與之類似,小分子 HER2 抑制劑吡咯替尼在乳腺癌中療效卓越,但在胃癌中療效不佳。返回臨床試驗,發現吡咯替尼在抑制 HER2 的同時還活化細胞周期的所有途徑,而使用細胞周期抑制劑 CDK4/6 抑制劑和抗 HER2 藥物進行組合,有效率提升 3 倍。該研究至今已完成瞭Ⅰ期研究,入組近 40 例患者,有效率(ORR)穩定在 40%。
沈琳教授提到,目前 HER2 陽性的患者是胃癌中治療療效最好、生存期最長的隊列,將來有望從 HER2 陽性的胃癌患者中更好地瞭解胃癌的特征,來實現其他亞群的進一步突破。
臨床研究中的堅守:關關難過關關過
沈琳教授強調:「執著和堅守是走向成功的基石」。臨床研究並非拿到實驗藥物就能夠成功,有時探索的過程是漫長而艱難的。
賽沃替尼(Savolitinib)是一種靶向 MET 激酶的小分子抑制劑。10 年前沈琳教授團隊便希望探索該藥在胃癌患者中的應用,但因為二代測序尚未普及,MET 擴增的胃癌患者基數較小導致入組困難,研究計劃最終停止。而隨著時代的發展、二代測序的普及,新的研究發現不僅晚期胃癌患者會出現 MET 擴增,抗 HER2 治療失敗的患者中 MET 擴增也是主要的耐藥原因。因此經過篩選,又開啟瞭靶向 MET 在胃癌中的關鍵性研究,這也是國際上首個靶向 MET 擴增的臨床研究,相信會為患者帶來可觀的臨床獲益。
首創新藥(first-in-class)的研發更是困難重重。CBP-1008 是一種以 FRα 和 TRPV6 為靶點,MMAE 為載藥的雙配體偶聯藥物,因為臨床探索太難,在國內研究甚少。而沈琳教授團隊自 2017 年開始研究該藥,經過 4 年艱難的探索,發現該藥在卵巢癌葉酸高表達人群中客觀有效,目前已經將該藥推薦給卵巢癌方向的團隊進一步探索。另外沈琳教授也提出,通過改變載藥類型,未來此類藥物也有望回到消化道腫瘤中作為治療手段。
沈琳教授總結道:「臨床醫生、科研人員、藥企專傢應當形成跨學科的團隊共同探索,重視早期臨床研究,才能獲得更好的臨床研究數據,推動腫瘤治療的研究進展。」
另外,新模式的探索對於消化道腫瘤精準治療也有重要意義,如跨瘤種適應癥的臨床研究。沈琳教授團隊進行的一項籃子試驗納入標準治療失敗後的 dMMR/MSI-H 胃腸腫瘤等實體瘤患者,使用國際上第一個皮下註射的 PD-L1 單抗恩沃利單抗獲得成功(客觀緩解率 43%,優於既往三線治療 7%)。這種皮下註射的給藥方式安全性優勢突出,且極大提高瞭患者就醫的便捷性和依從性,患者在社區診所甚至居傢即可接受治療,而帶來的療效與其他 PD-1 治療相同。
轉化研究:基於精準研究平臺的精準治療
為瞭更好地促進臨床前研究的發展,沈琳教授團隊總結瞭既往十年的經驗教訓,開始積極搭建諸多精準研究支撐平臺,包括:
擬人化模型庫(PDX/PDO)、體液活檢(CTC、外泌體)、多組學檢測平臺(轉錄組、蛋白組、多維免疫組化平臺)、基於核醫學手段的功能平臺等。
另外構建臨床信息數據庫,獲取有完整治療過程和轉歸的高質量樣本,為後續臨床研究建立瞭非常好的隊列,推動瞭十幾種藥物快速從臨床前進入臨床。對於消化系統腫瘤新藥研發產生重要影響。
沈琳教授團隊利用北京大學腫瘤醫院構建的臨床隊列、公開的平臺及各種可及的技術檢測手段,致力於優化消化道腫瘤的精準免疫治療。因為消化道腫瘤免疫微環境復雜,免疫治療預測標志物缺乏,因此沈琳教授團隊挖掘瞭多維度的免疫治療潛在標志物,包括蛋白組分型、基因組拷貝數變異負荷、24 基因 RNA、液體活檢(ctDNA bMSI 和外泌體)、免疫微環境分析及腸道菌群多樣性等,也發表瞭一系列臨床研究。
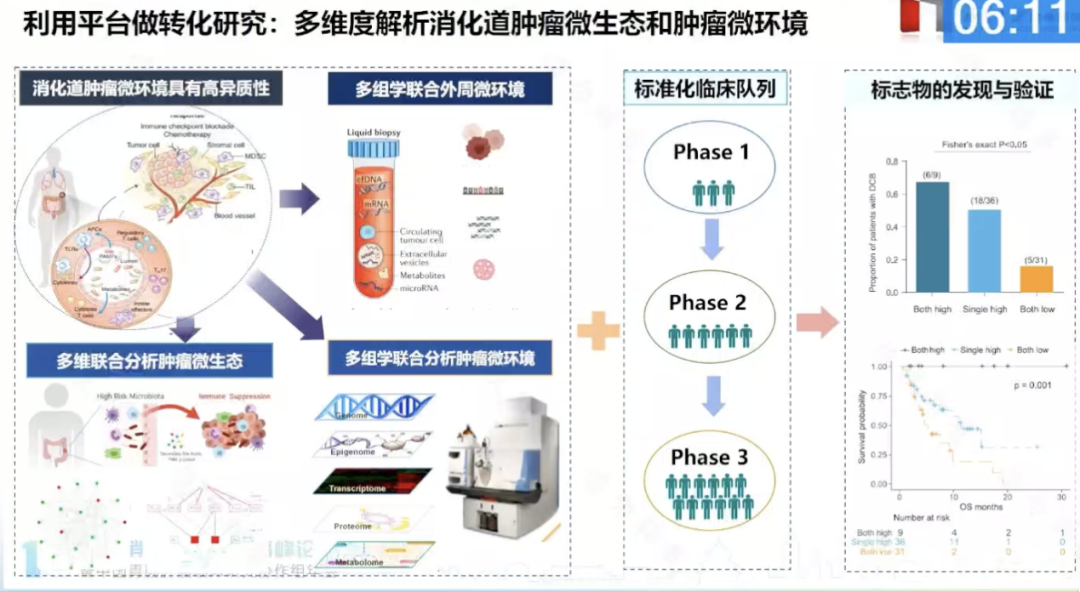
圖 2:基於精準研究平臺進行轉化研究
團隊通過對晚期胃癌患者治療前外周血循環腫瘤細胞(circulating tumor cell, CTC)研究,發現瞭胃癌患者外周血 CTC 與 HER2 治療選擇無關,而與 HER2 耐藥密切相關。對於腹膜轉移的晚期胃癌患者,研究發現腹水播散腫瘤細胞(aDTCs)相較外周血 CTC PD-L1 表達明顯升高,且腹水中巨噬細胞呈現耗竭表型,與 aDTCs 互相促進 PD-L1 介導的免疫逃逸。這些結論有助於瞭解晚期胃癌患者的免疫微環境,並推動新型免疫治療聯合策略的開發。
另外,胃癌免疫治療約有 1/3 的患者屬於免疫原發耐藥,MSI/dMMR、CPS、EBV 指導價值局限,而外泌體蛋白組有望更加精準、有效地實現免疫治療有效人群的劃分及療效檢測。團隊也利用血漿外泌體微量蛋白的 EV expression array 檢測構建芯片,希望用較為低廉的成本更好地指導免疫治療療效。
同樣,沈琳教授團隊也與北京大學數學院合作進行多維度的胃癌空間免疫微環境的構建,通過人工智能手段,從二維、三維角度提取胃癌微環境中免疫細胞與腫瘤細胞空間特征,真正瞭解胃癌免疫環境的復雜性,推動胃癌的精準治療。團隊在腸道菌群的研究中也取得瞭部分療效,研究發現多個與免疫治療獲益相關的菌群,未來也可以進行菌群移植相關的臨床研究。
除瞭以上這些「大文章」外,沈琳教授團隊也聚焦具有強臨床價值的「小問題」。如部分免疫治療高有效人群(MSI-H 人群)實際上對於免疫治療療效不佳。深入研究發現,基因差異(AKT1 或 CDH1 任意一個基因突變)可能限定瞭這些患者對於免疫治療的反應。
在消化道腫瘤的靶向治療領域,團隊也開展瞭一系列研究。EGFR 通路與食管癌發生發展密切相關,但靶向 EGFR 藥物在食管癌中數據不佳,二線有效率僅 2%-6.7%。泛靶點的 EGFR 抑制劑阿法替尼在部分食管癌患者中有效,有效率大約 10% 左右。團隊通過一系列臨床前模型的探索,繼之回歸臨床(NCT03940976),發現 EGFR 高表達(3+)和擴增人群對於 EGFR 抑制劑的反應較好,可將有效率提高至 30% 左右,而進一步進行 ALK、NTRK3、NTRK2 的 3 基因(3-gene signature)篩選富集,可將這部分患者的有效率提高至 77.8%。可以看到,通過精準治療手段篩選人群,有效率可以提到 10-30 倍以上!
食管癌術後輔助治療方面,食管癌術後肺轉移率高,轉移機制不明,且缺乏幹預手段。如何延長患者術後的無病生存時間成為重要的研究方向。沈琳教授團隊研究發現在腫瘤實際發生轉移之前,首先會搭建非腫瘤細胞組成的「巢穴」,而靶向轉移前微環境,讓腫瘤細胞「無傢可歸」(homeless)是有前景的發展方向,目前相關臨床研究正在進行。
Claudin18.2(CLDN18.2)作為近年來萬眾矚目的靶點,已有多種臨床階段在研模式,如何在競爭中抓到關鍵點、進行最佳佈局至關重要。
沈琳教授團隊對於免疫微環境特征分析發現 CLDN18.2 高表達腫瘤中非耗竭的 CD8+T 細胞非常活躍,提示 CLDN18.2 腫瘤具有更多可發揮 T 細胞效應的 CD8 及 CD4+T 細胞,具有 CART 療法成功的先決條件。因此該團隊開創瞭國際實體瘤 CLDN18.2 CAR-T 細胞治療,目前正在進行確證性的隨機對照研究。沈琳教授也分享瞭一例多線治療後的胃癌伴腹膜轉移及臍周結節的患者,在接受 1 次治療後達到 PR 和持續緩解超過 56 周。
沈琳教授總結:
「從臨床前到臨床,再從臨床到臨床前,應當形成一個全方位、多層面、重轉化、一體化的全鏈條式雙向精準研究體系。而這些可持續發展的保證是對於臨床問題不倦的探索,雖然在探索途中可能會遭遇失敗,但我們屢敗屢戰,屢戰總有成功的那一天。我相信上消化道腫瘤的精準治療瓶頸終有一天會突破!」





發表評論 取消回复