結直腸癌(CRC)是全球第二常見的癌癥,大約 40% 的病例表現為新發轉移性結直腸癌(mCRC)。mCRC 的特征在於特殊驅動基因組突變包括 BRAF、KRAS 和 TP53 基因突變,KRAS 突變與多種下遊途徑的組成性激活有關,包括觸發和促進致癌作用的 RAF-MEK-ERK 和 PIK3/mTOR 途徑。KRAS G12C 突變見於約 3% 的轉移性結直腸癌,對一線化療反應持續時間更短相關,臨床預後較差。
一、關於 KRAS G12C
KRAS G12C 抑制劑 Sotorasib(Soto) 單藥治療 KRAS G12C 突變的 mCRC 化療難治性患者的客觀緩解率(ORR)為 9.7%。在 2022 年 ESMO 和 ESMO ASIA 大會報道瞭 40 例難治性 mCRC 患者的劑量擴展隊列的研究結果。共計 40 例患者接受 sotorasib 聯合帕尼單抗治療,其中 75% 為女性,中位年齡 57.5 歲,既往中位治療線數為 2,ORR 為 30%(95%CI:16.6%~46.5%)。DCR 為 93%(95%CI:79.6%~98.4%)。
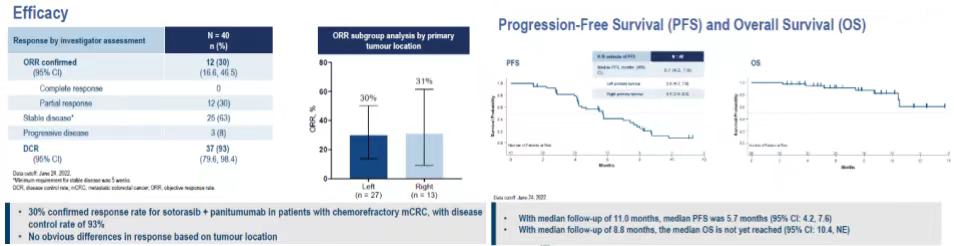
二、2023 ASCO 重磅:靶免+化療 ORR 達 58.1%
在今年的 ASCO 會議上,發佈瞭最新研究 Sotorasib(Soto) 聯合帕尼單抗(Pmab)和 FOLFIRI 治療既往治療過的 KRAS G12C 突變轉移性結直腸癌(mCRC)的臨床研究 —CodeBreaK1011b 期,主要關於安全性和有效性,首次報告瞭 KRAS G12C 抑制劑聯合 EGFR 抑制劑和化療在既往接受過 mCRC 治療的患者中的首次結果。
該研究假設 Soto 聯合 Pmab 和 FOLFIRI 將進一步提高 Soto 的療效,同時保持可管理的安全性。方法:Pts 來自 CodeBreaK 101 子方案 H(NCTO4185883)和擴展隊列,接受 Soto(960 mg PO 每日)加 Pmab(6 mg/kg IV Q2W)和標準劑量 FOLFIRI(IV Q2W)。關鍵入選標準是 KRAS G12C 突變的 mCRC。主要終點是安全性,次要終點包括療效和藥代動力學。
研究結果:截至 2022 年 11 月 30 日,33 名患者(中位年齡:53 歲;48% 為女性接受治療(劑量探索組 6 例,劑量擴大組 27 例)。分別有 33% 和 67% 的患者接受 1 或 2 線治療;97% 的患者既往使用過氟嘧啶,73% 的患者既往使用過伊立替康。
在劑量限制性毒性(DLT)評估期間(前 28 天),劑量水平 1 的 6 名患者均未出現(DLT),應用 Soto(每天 960 mg PO)加 Pmab(6 mg/kgIV Q2W)和 FOLFIRI(IV Q2W)的患者(劑量擴大組),32 名(97.0%)患者發生瞭任何級別的治療相關不良事件(TRAEs):1 名患者因 3 級 ALT 升高而停止瞭整個方案;15 人(45.5%)患有 2-3 級 TRAEs(最常見的是皮膚病;n = 5),沒有致命的 TRAES。
安全性調查結果與 Soto 的已知特征一致。在 31 名可評估緩解的患者中,確認的 ORR(所有部分緩解)為 58.1%(95% Cl:39.1,75.5)。2 例既往 Soto 患者獲得部分緩解(n = 1)和病情穩定(n = 1)。疾病控制率 93.5%(95%Cl:78.6),99.2)。中位隨訪時間分別為 5.7 和 7.4 個月。無進展期和總生存期數據分別尚不成熟。將公佈全入組數據。
研究結論:在這個新組合的第一個數據集中,Soto 加 Pmab 和 FOLFIRI 在預處理 KRAS G12C 突變的 mCRC 中顯示出良好的安全性和有效性,確認的 ORR 為 58.1%。不良事件是可控的,並且符合所使用藥物的預期安全性,並且沒有臨床意義的 Soto 和伊立替康 PK 相互作用。
三、難治的原因
患者對單藥 KRAS G12C 抑制劑的反應似乎存在差異,可能存在耐藥性因素。KRAS G12C 抑制的原發性耐藥很少見,但有研究表明,對 KRAS 的依賴程度因不同的腫瘤類型而異,有多種途徑包括 PI3K/AKT/mTOR 途徑的上調,觸發對 KRAS 抑制的抵抗。
反應持續時間相對較短,可能是由於驅動腫瘤生長並導致獲得性耐藥的非 KRAS 依賴性途徑的上調。在 CodebreaK-100 中,額外的突變分析顯示,獲得性治療耐藥主要是由受體酪氨酸激酶基因傢族內的突變驅動的,包括 EGFR、ERBB2、KIT 和 ROS1。
小結
盡管 KRAS G12C 突變僅占一小部分轉移性結直腸癌患者,考慮到總患病群體及其難治性,開展更加有效且安全的臨床研究仍是十分必要的
作者:時間簡史;排版:林舒雅



發表評論 取消回复