本文作者:云也
风波跌宕 5 个月后,这款已上市 8 年的重要肝病药物,终究还是撤市了。
风波起于欧洲。今年 6 月,欧洲药品管理局(EMA)称奥贝胆酸的临床获益不大于风险,建议撤销其上市许可。
经历了多次波折,时间来到 12 月,其生产厂商 Advanz Pharma 终于宣布,欧洲联盟普通法院已正式确定将不再延长欧洲委员会(EC)关于撤销 OCALIVA®(奥贝胆酸)在欧洲的附条件上市销售许可的决定。
一代传奇正式撤市,奥贝胆酸真的凉透了吗?那些还在申报的仿制药又会怎么样?
撤销→恢复→再撤销
一代传奇正式撤市
6 月 28 日,欧洲药品管理局(EMA)的一则信息引起了巨大震动:经人用药品委员会(CHMP)审查,重要肝病药物奥贝胆酸的临床获益不大于风险,建议撤销其上市许可 [1]。

图源:资料 1
就在业界还在等待预期中漫长的论证和反转,这则建议却很快下文——9 月 3 日,欧洲委员会(EC)宣布:撤销奥贝胆酸在欧洲的附条件上市许可(CMA)[2]。
这一决定不仅让医药界哗然,更让众多依赖此药的患者和他们的医生不知所措。当时,Advanz Pharma 回应不认同 EC 的决定,认为该决定将使大量对奥贝胆酸反应良好的 PBC 患者,在治疗选择有限的情况下面临疾病进展的风险增加。
然而,仅仅 2 天后,事情又发生了戏剧性的转折,普通法院却宣布了暂停 EC 关于将这款药撤市的决定,奥贝胆酸竟然「死里逃生」。
从后续事实来看,EMA 的核心结论「现有数据无法证实奥贝胆酸的临床获益超过其潜在风险」,并没有被推翻。关键的临床研究结果显示,奥贝胆酸与安慰剂在死亡、肝移植或肝功能失代偿的主要复合终点中,未表现出统计学差异。
另外,安全性问题也是欧洲委员会考虑撤销奥贝胆酸 CMA 的重要因素之一。较高剂量的奥贝胆酸可能导致肝损伤风险增加,且该药物还容易引起明显的瘙痒等副作用。
结论没问题,那为何奥贝胆酸还能获得普通法院支持,短暂「死里逃生」?
这主要还是出于法律程序和患者权益的考量。欧盟普通法院认为:「在欧洲委员会做出最终决定之前,应该给予患者和医药界更多的时间和机会来应对这一变化。」

图源:资料 3
那么问题来了,为何说「需要给患者和医药界时间」,奥贝胆酸就这么重要吗?
首先,奥贝胆酸曾是被寄予厚望的传奇,它虽然不是一线用药,却有着非常独特的地位,是 20 年来唯一获批的原发性胆汁性肝硬化的重磅药物。
最初,奥贝胆酸是奔着治疗非酒精性脂肪性肝炎(NASH)研发,但很遗憾未能取得预期的成功,研究人员转而开始探索奥贝胆酸在其他疾病中的治疗潜力,继而发现奥贝胆酸在原发性胆汁性胆管炎(PBC)治疗中展现出了独特的价值。
PBC 是一种罕见的进行性自身免疫性疾病,主要影响女性,由肝脏胆管破坏引起,会导致炎症、瘢痕形成和肝硬化,并增加患肝癌的风险。
对于对标准一线疗法熊去氧胆酸(UDCA)无反应或不能耐受的 PBC 患者,奥贝胆酸是他们的一线希望,因此,奥贝胆酸成功在欧洲获得了附条件上市许可,用于治疗这类 PBC 患者。

Advanz Pharma 回应奥贝胆酸在欧洲正式撤市 图源:资料 4
仿制药尴尬了
Advanz Pharma 其实并非奥贝胆酸的原研药企。2022 年,它以 4.05 亿美元的预付款,4500 亿美元的里程碑付款收购了奥贝胆酸原研药企 Intercept 在欧洲、加拿大及美国以外所有市场的大部分子公司和权益。
没卖两年就黄了,Advanz Pharma 的憋屈可见一斑。
能感同身受 Advanz Pharma 的憋屈的,莫过于入局仿制奥贝胆酸的药企。
奥贝胆酸 2023 年销售额全球销售额为 3.44 亿美元,且市场预期一直积极。
目前,奥贝胆酸在印度、孟加拉国已有仿制药上市,我国奥贝胆酸原研药品并未进口上市,但国内仿制大军早已启程。
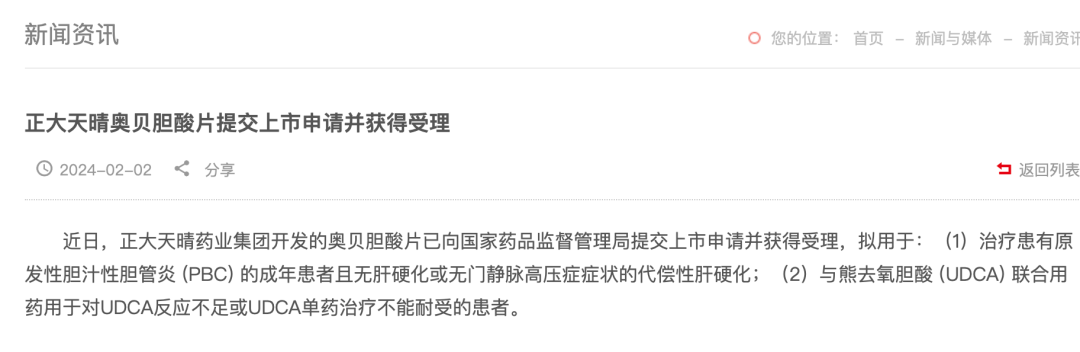
2021 年 3 月,奥贝胆酸入选我国第二批鼓励仿制药品目录。正大天晴和恒瑞医药进展最快,先后递交了上市申请,但均未通过。泰州复旦张江、扬子江药业、四川科伦药业和成都倍特药业等多家企业都已获准开展临床。
2024 年 2 月,国家药监局药品审评中心(CDE)官网公示,受理正大天晴药业集团股份有限公司递交了奥贝胆酸片的上市申请,有望成为国内首仿。
图源:药企官网
有业内人士表示,国内是国内,国外是国外,做了验证性临床试验,就可以表明已验证安全性和有效性。欧美与我国有人种差异,国内有独立自主认知,正常审核即可。
但要说没影响,那也不免太乐观了。
国内审批机构肯定也会参考各国的审批情况。欧洲做出撤市决定,参考的是近 8 年的 Ⅳ 期临床数据。目前国内验证性临床都是参考的 Ⅲ 期数据,因此是否还能继续获批,得看审批机构如何考量。
那么问题自然就回到原点:奥贝胆酸到底有多大问题,真的会凉透吗?
临床用药,会受多大影响?
法院不再坚持,但药企显然还没放弃。Advanz Pharma 仍表示不同意此撤销决定,正在与相关国家机构讨论。CEO Steffen Wagner 称:「我们对普通法院的裁决非常失望。奥贝胆酸是欧洲大量 PBC 患者急需的治疗选择。」[4]

图源:资料 4
在 PBC 的治疗中,UDCA 一直是首选药物。但高达 50% 的患者在接受 UDAC 治疗后疾病并未得到改善。据一篇最新综述分析,PBC 其他有潜力的二线疗法都有效,但都不像奥贝胆酸这样已有较充足的、长期的现实世界疗效和安全性数据 [5]。
EMA 的撤市建议,主要是建立在 747-302 研究的内部对照分析数据上,但从该研究的外部对照数据来看,使用奥贝胆酸的确可以显著降低 PBC 患者出现负面临床结果的风险。
美国华盛顿州西雅图华盛顿州立大学 Elson S Floyd 医学院西北肝脏研究所所长 Kris Kowdley 认为:「此项分析结果表明奥贝胆酸治疗可能会改善 PBC 患者的临床结果,并证明了预先指定的外部对照数据在验证性试验中的重要性。外部对照研究在 PBC 等罕见疾病的临床试验中特别重要,在这些试验中,使用安慰剂对患者可能不公平。」
然而,美国 FDA 却又从安全性角度,给奥贝胆酸又来了一击。
11 月 12 日,保留奥贝胆酸在美权益的 Intercept Pharmaceuticals 收到了美国 FDA 的完整回复信(CRL),依据 9 月举行的胃肠道药物咨询委员会会议,不支持奥贝胆酸对 PBC 临床结局的益处大于风险,补充新药申请被驳回 [6]。
12 月 12 日,FDA 继续发布上市后临床试验数据的审查结果,认为在没有肝硬化的 PBC 患者中,奥贝胆酸会导致肝损伤的风险增加 [7]。

图源:资料 7
FDA 在新闻稿中表示,已通知医生和患者这一安全信息,无论患者是否已有肝硬化,用药过程中都需经常进行肝脏测试监测,必要时应及时停用。
纷争依然在继续,拉什大学医学中心实体器官移植副主任、肝病科科长 Nancy Reau 的观点,或许是奥贝胆酸走向撤市的最好注脚:
「我们对 PBC 生化缓解的理解一直在进步。此前很长一段时间,除了一线的 UDCA 外,我们很需要奥贝胆酸,因为这是很多患者唯一的治疗选择。PBC 患者需要 10~30 年才能看到最终的治疗结果,能在几年内就看到疗效,肯定是更轻症的患者。因此现在就下定论为时太早,未来也可能还有新的指标。」
「我理解欧盟和美国 FDA 的决定,我只是认为这不免会让一部分患者陷入困境。」

图源:资料 8
但毕竟「后浪」还是在成长的。
美国 FDA 于今年 6 月批准 Elafibranor 作为二线 PBC 治疗的第一款 PPAR 激动剂。今年 9 月时,EMA 也批准了其与 UDCA 联用的疗法,吉利德的 Livdelzi (seladelpar)也正在等待 EMA 审批。
奥贝胆酸仍是唯一一款靶向 FXR 的 PBC 二线药物,但却不再是唯一的 PBC 二线药物。
临床有了其他选项,这也是欧洲不再选择保住奥贝胆酸的底气。
策划:云也|监制:islay
题图来源:图虫创意 + EMA 官网
参考资料:
[1]https://www.ema.europa.eu/en/news/ema-recommends-revoking-conditional-marketing-authorisation-ocaliva
[2]https://www.advanzpharma.com/news/2024/advanz-pharmas-response-to-european-commission-revocation-of-conditional-marketing-authorization-for-ocaliva-in-rare-disease-primary-biliary-cholangitis-pbc
[3]https://www.ema.europa.eu/en/documents/referral/ocaliva-article-20-procedure-ema-recommends-revoking-conditional-marketing-authorisation-ocaliva_en.pdf
[4]https://www.advanzpharma.com/news/2024/advanz-pharmas-response-to-the-reversal-of-the-suspension-of-the-european-commission-decision-on-the-ocaliva-conditional-marketing-authorisation-in-europe
[5]Cumpian, N.A., Choi, G. & Saab, S. Review of Current and Upcoming Second-Line Treatments for Primary Biliary Cholangitis. Dig Dis Sci (2024). https://doi.org/10.1007/s10620-024-08742-w
[6]FDA. Serious liver injury being observed in patients without cirrhosis taking Ocaliva (obeticholic acid) to treat primary biliary cholangitis. December 12, 2024. Accessed December 12, 2024. https://www.fda.gov/drugs/drug-safety-and-availability/serious-liver-injury-being-observed-patients-without-cirrhosis-taking-ocaliva-obeticholic-acid-treat?utm_medium=email&utm_source=govdelivery
[7]Brooks, A. FDA Issues CRL to Obeticholic Acid (Ocaliva), Denies Full Approval for PBC. HCPLive. November 12, 2024. Accessed December 12, 2024.
https://www.hcplive.com/view/fda-issues-crl-obeticholic-acid-ocaliva-denies-full-approval-pbc
[8]https://www.hcplive.com/view/nancy-reau-md-obeticholic-acid-future-pbc-fda-advisory-committee-meeting




發表評論 取消回复